
- •Концепции современного естествознания Учебное пособие самара
- •Программа курса «Концепции современного естествознания»
- •Задание для контрольной работы
- •МатериаЛы для изучения основных тем курса
- •Тема 1. Соотношение двух культур – естественно-научной и гуманитарной
- •Задание 1
- •Задание 2
- •Методы научного познания
- •Задание 3
- •Принципы научного познания
- •Задание 4
- •Тема 2. Этапы развития естествознания
- •Задание 5
- •Задание 6
- •Задание 7
- •Тема 3. Основы теории систем в современном естествознании
- •Задание 8
- •Задание 9
- •Тема 4. Физическая картина мира
- •Задание 10
- •Строение атома
- •1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) орбитам.
- •2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую.
- •Электронное облако
- •Принципы заполнения электронных орбиталей
- •Составление электронной формулы
- •Задание 11
- •Задание 12
- •Явление радиоактивности
- •Виды радиоактивных излучений
- •Характеристики радиоактивных (ионизирующих) излечений (ии)
- •Деление ядер
- •Задание 13
- •Задание 14
- •Элементарные частицы
- •Теория относительности Постулаты теории относительности а. Эйнштейна
- •Задание 15
- •Тема 5. От мегамира к планете Происхождение Вселенной
- •Галактики
- •Основные характеристики звёзд
- •Эволюция звезд
- •Задание 16
- •Общие сведения о Солнце
- •Задание 17
- •Задание 18
- •Планеты Солнечной системы
- •Некоторые показатели планет Солнечной системы
- •Задание 19
- •Задание 20
- •Планета Земля
- •Некоторые показатели геосфер Земли
- •Задание 21
- •Задание 22
- •Атмосфера и гидросфера земли
- •Состав атмосферного воздуха
- •Значение атмосферы для планеты и живых организмов:
- •Задание 25
- •Тема 6. От химической к биологической эволюции Проблемы эволюционной химии
- •Задание 26
- •История Эволюционного учения
- •Задание 27
- •Циферблат биологической эволюции
- •Задание 28
- •Клеточные органоиды
- •Свойства генетического кода
- •Задание 29
- •Геннетическая инженерия и клонирование
- •Клонирование
- •Задание 30
- •Тема 7. Биосфера и человечество
- •Задание 31
- •Рекомендуемая литература
- •Рекомендуемые internet-ресурсы
- •Периодическая система элементов д. И. Менделеева
- •Краткая история естествознания до 1900 г.
- •Концепции современного естествознания
- •443030, Г. Самара, ул. Желябова, 21
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую.
Атом состоит из ядра и окружающего его электронного облака. Ядро атома состоит из протонов и нейтронов. Общее название протонов и нейтронов – нуклоны. Электроны несут отрицательный электрический заряд, протоны – положительный. Число протонов в ядре равно числу электронов в облаке. Нейтроны заряда не несут, поэтому атом в целом нейтральная частица.
Частица |
Заряд |
Масса, кг |
Протон |
+1 |
1,67·10-27 |
Нейтрон |
0 |
1,67·10-27 |
Электрон |
-1 |
9,11·10-31 |
Таким образом, масса электрона почти в 2000 раз меньше, чем масса протона.
Ядро атома
Число протонов в ядре обозначается Z и совпадает с порядковым номером элемента в таблице Менделеева |
Число нейтронов в ядре обозначается N |
Общее число протонов и нейтронов обозначается А и называется массовым числом А=Z+N |
Обозначение
ядер в таблице Менделеева
|
||
Атомы
с одинаковым зарядом ядра (одинаковым
числом протонов), но различающиеся
числом нейтронов в ядре называются
изотопами.
Таким образом, изотопы отличаются
друг от друга только массовым числом.
Поскольку нейтроны не влияют на
химические свойства, изотопы одного
и того же элемента химически неразличимы.
Например,
|
||
Электронное облако
Движение электрона невозможно описать теми же способами, какими физики описывают движение обычных физических тел. Можно лишь говорить о некоторой вероятности обнаружить электрон в каком-нибудь участке околоядерного пространства. Пространство вокруг ядра, в котором вероятность нахождения электрона наиболее высока, называется электронной орбиталью. Таким образом, квантовая механика – наука, описывающая движение микрочастиц, – отказалась от наглядного образа электрона и предлагает представлять его в виде электронного облака – некой области пространства, где нахождение электрона наиболее вероятно.
Форма и размеры электронных облаков характеризуются определенным набором квантовых чисел.
-
n
главное
принимает целочисленные значения от 1 до 7
размер электронного облака
l
орбитальное (побочное)
при данном значении n принимает значения от 0 до n-1
форма электронного облака
m
магнитное
при данном значении l принимает значения –l...+l
ориентация орбитали в пространстве атома
s
спиновое
принимает значения -1/2 и +1/2
магнитный момент, при вращении электрона вокруг своей оси
числовым значениям l соответствуют буквенные обозначения
0
1
2
3
s
p
d
f
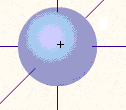
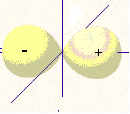
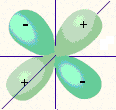
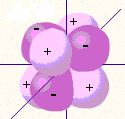
Рис. 4. Формы электронных орбиталей
Орбитальное квантовое число
Магнитное квантовое число
Число орбиталей с данным значением l
l
ml
2l + 1
0 (s)
0
1
1 (p)
–1, 0, +1
3
2 (d)
–2, –1, 0, +1, +2
5
3 (f)
–3, –2, –1, 0, +1, +2, +3
7
