
- •Конспект лекционных занятий введение
- •Тема 1. Термодинамическая система, термодинамический процесс. Основные термодинамические параметры состояния. Уравнения состояния идеальных газов Термодинамическая система
- •Термодинамический процесс
- •Основные термодинамические параметры состояния
- •Уравнение состояния
- •Уравнение состояния идеальных газов
- •Уравнение состояния реальных газов
- •В опросы для самопроверки
- •1 М2 воздуха содержит 1 кг воды в виде мелких капель, распыленных по
- •Что произойдет с температурой системы, если при постоянном удельном
- •Тема 2. Первый закон термодинамики
- •Работа расширения
- •Теплота
- •Теплоёмкость газов
- •Энтальпия
- •Вопросы для самопроверки
- •Тема 3. Второй закон термодинамики.
- •Энтропия
- •Общая формулировка второго закона
- •Вопросы для самопроверки
- •Тема 4. Прямой цикл Карно. Обобщённый (регенеративный цикл Карно). Обратный цикл Карно. Прямой цикл Карно
- •Обобщенный (регенеративный) цикл Карно
- •Обратный цикл Карно.
- •Вопросы для самопроверки
- •Тема 5. Термодинамические процессы идеальных газов в закрытых системах.
- •Тема 6. Смеси идеальных газов
- •Тема 7. Уравнение первого закона термодинамики для потока. Истечение из суживающегося сопла. Уравнение первого закона термодинамики для потока
- •Истечение из суживающегося сопла
- •Вопросы для самопроверки
- •Тема 8. Основные закономерности течения газа в соплах и диффузорах. Дросселирование газов и паров.
- •Разделив (91) на (90), получим
- •После дифференцирования уравнения адиабаты получаем
- •Вопросы для самопроверки
- •Тема 9. Процессы сжатия в идеальном компрессоре. Многоступенчатое сжатие. Эксергия потока рабочего тела.
- •Эксергия потока рабочего тела
- •Вопросы для самопроверки
- •Тема 10. Состав и основные характеристики жидкого и газообразного топлива. Теплота сгорания топлива. Условное топливо. Приведенные характеристики. Классификация топлив
- •Тема 11. Основы расчета и основные параметры топочных устройств. Особенности сжигания газообразных, жидких и твердых топлив.
- •Тема 12. Печи химической промышленности. Принципиальная схема топливной печи. Классификация печей химической промышленности. Основные типы печей, особенности их конструкции. Тепловой баланс печей
- •Виды печей?
- •Тема 11. Паровой котел и его основные элементы. Поверхности нагрева котла. Конструкции котлов, тепловой баланс парового котла. Коэффициент полезного действия котла.
- •Тема 12. Действие рабочего тела на лопатки. Активные, реактивные турбины. Мощность и кпд турбины. Классификация турбин.
- •Тема 14. Технико-экономические показатели двс. Тепловой баланс двигателя. Токсичность выхлопных газов двс.
- •Тема 15. Энеретический и эксергетический методы оценки несовершенства технологических процессов.
Тема 6. Смеси идеальных газов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона. Газообразные вещества, близкие по свойствам к идеальным газам и представляющие собой механическую смесь отдельных компонентов различных газов, химически не реагирующие между собой, называются газовыми смесями. В качестве примера можно назвать продукты сгорания топлива в ДВС, топках печей и паровых котлов и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно Сумме парциальных давлений всех входящих в нее компонентов:
![]() (68)
(68)
Парциальное давление рi – давление, которое бы имел газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными и мольными долями.
Массовой доле называется отношение массы отдельного компонента Мi к массе смеси М:
gi =М i/М (69)
Очевидно,
что
![]() и
и
![]() .
.
Объемная доля представляет собой отношение приведенного объема газа Vi к полному объему смеси V:
ri = Vi/ V (70)
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси:
Vi =Vрi/р (71)
Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля Vμ на число молей этого компонента, т. е. Vi = VμNi, а объем смеси – по формуле V = VμN. Тогда Vi / V= riNi/N, и следовательно, задание смеси идеальных газов мольными долями равнозначно заданию ее объемными долями.
Модуль 3. Особенности термодинамики открытых систем
Тема 7. Уравнение первого закона термодинамики для потока. Истечение из суживающегося сопла. Уравнение первого закона термодинамики для потока
Как указывалось выше, под открытыми понимаются термодинамические системы, которые кроме обмена теплотой и работой с окружающей средой допускают также и обмен массой. В технике широко используются процессы преобразования энергии в потоке, когда рабочее тело перемещается из области с одними параметрами (р1, v1) в область с другими (р2, v2). Это, например, расширение пара в турбинах, сжатие газов в компрессорах.
Будем рассматривать лишь одномерные стационарные потоки, в которых параметры зависят только от одной координаты, совпадающей с направлением вектора скорости, и не зависят от времени. Условие неразрывности течения в таких потоках заключается в одинаковости массового расхода т рабочего тела в любом сечении:
m = F∙c/υ = const (72)
где F — площадь поперечного сечения канала; с — скорость рабочего тела.
Рассмотрим термодинамическую систему, представленную схематически на рис. 16. По трубопроводу 1 рабочее тело с параметрами Т1, р1, v1 подается со скоростью с1 в тепломеханический агрегат 2 (двигатель, паровой котел, компрессор и т.д.). Здесь каждый килограмм рабочего тела в общем случае может получать от внешнего источника теплоту q и совершать техническую работу lтех, например, приводя в движение ротор турбины, а затем удаляется через выхлопной патрубок 3 со скоростью с2, имея параметры Т2, p2, υ2.
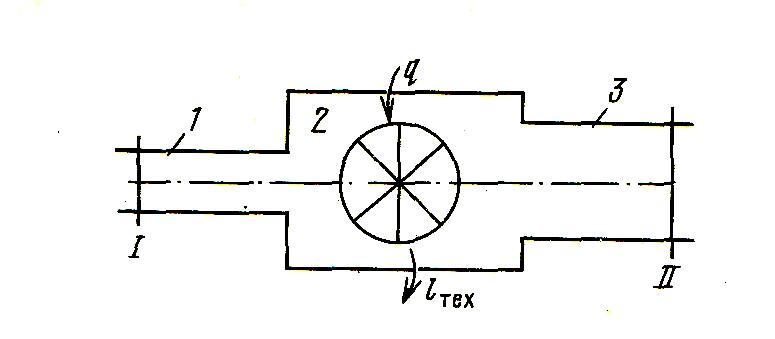
Рис. 16. Открытая термодинамическая система
Если в потоке мысленно выделить замкнутый объем рабочего тела и наблюдать за изменением его параметров в процессе перемещения, то для описания его поведения будут пригодны все полученные выше термодинамические соотношения и, в частности, первый закон термодинамики в обычной записи:
q = ∆u+ l
Внутренняя энергия есть функция состояния рабочего тела, поэтому значение и1 определяется параметрами рабочего тела при входе (сечение потока 1), а значение и2 — параметрами рабочего тела при выходе из агрегата (сечение 2).
Работа расширения l совершается рабочим телом на поверхностях, ограничивающих выделенный движущийся объем, т. е. на стенках агрегата и границах, выделяющих этот объем в потоке. Часть стенок агрегата неподвижна, и работа расширения на них равна нулю. Другая часть стенок специально делается подвижной (рабочие лопатки в турбине и компрессоре, поршень в поршневой машине), и рабочее тело совершает на них техническую работу lтех. При входе рабочее тело вталкивается в агрегат. Для этого нужно преодолеть давление р1. Поскольку р1 = const, то каждый килограмм рабочего тела может занять объем v1 лишь при затрате работы, равной lвт.= - p1 v1.
Для того чтобы выйти в трубопровод 3, рабочее тело должно вытолкнуть из него такое же количество рабочего тела, ранее находившегося в нем, преодолев давление р2, т. е. каждый килограмм, занимая объем v2, должен произвести определенную работу выталкивания lвыт.= p2 v2
Сумма lв= p2 v2 - p1 v1 называется работой вытеснения
Если скорость с2 на выходе больше, чем с1 на входе, то часть работы расширения будет затрачена на увеличение кинетической энергии рабочего тела в потоке, равное c22 /2 — c12 /2.
Наконец, в неравновесном процессе некоторая работа lтр может быть затрачена на преодоление сил трения. Окончательно:
l= lтех.+ (p2 v2 - p1 v1)+ (c22 /2 — c12 /2) +lтр. (73)
Теплота, сообщенная каждому килограмму рабочего тела во время прохождения его через агрегат, складывается из теплоты qвнеш, подведенной снаружи, и теплоты qтр, в которую переходит работа трения внутри агрегата, т. е.
q= qвнеш + qтр
Подставив полученные значения q и l в уравнение первого закона термодинамики, получим:
qвнеш + qтр =u2 - u1 + lтех.+ p2 v2 - p1 v1+ c22 /2 — c12 /2 +lтр.
Поскольку теплота трения равна работе трения (qтр = lтр), a u + pv=h, окончательно запишем:
qвнеш = h2 – h1 + lтех.+ (c22 — c12 ) /2 (74)
Это и есть выражение первого закона термодинамики для потока, который можно сформулировать так: теплота, подведенная к потоку рабочего тела извне, расходуется на увеличение энтальпии рабочего тела, производство технической работы и увеличение кинетической энергии потока.
В дифференциальной форме уравнение (74) записывается в виде:
δqвнеш =dh + δlтех + d(c2/2). (75)
Оно справедливо как для равновесных процессов, так и для течений, сопровождающихся трением.
Теплообменный аппарат (устройство, в котором теплота от жидкой или газообразной среды передается другой среде). Для него lтех = 0, а (c22-c12) <qвнеш, поэтому
qвнеш = h2 – h1 (76)
Следует подчеркнуть, что для теплообменника, установленного в потоке, это выражение справедливо не только в изобарном процессе, но и в процессе с трением, когда давление среды уменьшается из- за сопротивления.
Тепловой двигатель. Обычно (c22 — c12) <lтех , а qвнеш = 0, поэтому рабочее тело производит техническую работу за счет уменьшения энтальпии:
lтех = h2 – h1 (77)
Величину h2 – h1 называют располагаемым теплоперепадом.
Компрессор. Если процесс сжатия газа в компрессоре происходит без теплообмена с окружающей средой (qвнеш = 0) и с1=с2, что всегда можно обеспечить надлежащим выбором сечений всасывающего и нагнетательного воздухопроводов, то
lтех = h1 —h2. (78)
В отличие от предыдущего случая здесь h1<h2,, т.е. техническая работа в адиабатном компрессоре затрачивается на увеличение энтальпии газа.
Сопла и диффузоры. Специально спрофилированные каналы для разгона рабочей среды, и придания потоку определенного направления называются соплами. Каналы, предназначенные для торможения потока и повышения давления, называются диффузорами. Техническая работа в них не совершается, поэтому уравнение (40) приводится к виду:
δqвнеш =dh + d(c2/2).
С другой стороны, для объема рабочего тела, движущегося в потоке без трения, применимо выражение первого закона термодинамики для закрытой системы δqвнеш = dh — υdp.
Приравняв правые части двух последних уравнений, получим
cdc= —υdp. (79)
Откуда видно, что dc и dp всегда имеют противоположные знаки. Следовательно, увеличение скорости течения в канале (dc>0) возможно лишь при уменьшении давления в нем (dp<0). Наоборот, торможение потока (dc<0) сопровождается увеличением давления (dp>0).
Так как длина сопла и диффузора невелика, а скорость течения среды в них достаточно высока, то теплообмен между стенками канала и средой при малом времени их контакта настолько незначителен, что в большинстве случаев им можно пренебречь и считать процесс истечения адиабатным (qвнеш = 0). При этом уравнение (44) принимает вид:
(c22 — c12 ) /2 = h1 —h2 (80)
Следовательно, ускорение адиабатного потока происходит за счет уменьшения энтальпии, а торможение потока вызывает ее увеличение.
Проинтегрировав соотношение (44) и сравнив его с уравнением (80), получим, что для равновесного адиабатного потока,
 при
qвнеш
= 0,
при
qвнеш
= 0,
qтр=0,
т. е. располагаемая работа при адиабатном расширении равна располагаемому теплоперепаду.
