
- •Техніка безпеки при роботі в лабораторії.
- •Перша допомога.
- •Розділ і Біогенні s- та р-елементи, біологічна роль, застосування в медицині
- •Вміст у організмі та значення для організму макроелементів
- •Якісна реакція на катіони лужних металів - фарбування полум'я в наступні кольори:
- •Загальні хімічні властивості
- •Біологічна роль та застосування в медицині s та р – елементів
- •Заняття №1 Тема: Біогенні s-елементи; біологічна роль, застосування в медицині.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Заняття №2
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •3.Фізичні властивості :
- •4. Хімічні властивості d-елементів і їх сполук виходячи з будови атомів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання:
- •Приклад завдань для тестового контролю:
- •Методика виконання лабораторної роботи
- •Розділ 3 Комплексні сполуки
- •Класифікація та номенклатура комплексних сполук
- •Хімічний зв’язок у комплексних сполуках
- •Заняття №4
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Розділ 4 Вчення про розчини. Кислотно-основна рівновага біологічних рідин в організмі
- •Приклади розв’язування задач за темою «Розчини»
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 5. Розчини електролітів
- •Слабкі електроліти.
- •Сильні електроліти.
- •Теорія кислот і основ.
- •Дисоціація води.
- •Гідроліз солей. Ступінь та константа гідролізу
- •Буферні розчини.
- •Біохімічні буферні системи.
- •Самостійна позааудиторна робота студентів.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 7
- •Основні поняття:
- •1Г вуглеводів 19,6 кДж
- •Хімічний склад і калорійність харчових продуктів
- •Задача 3
- •Задача 4
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
- •Розділ 8. Хімічна кінетика
- •Залежність швидкості реакції від різних факторів.
- •Теорія активних комплексів.
- •Теорії каталізу
- •Ферментативний каталіз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9
- •Гальваноз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •1 Правило: Кристалічну гратку адсорбенту добудовують ті йони, що входять до її складу, ізоморфні з її йонами, утворюють з йонами цієї гратки важкорозчинні сполуки.
- •2 Правило: На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду яких протилежний знаку заряду поверхні адсорбенту.
- •Типи хроматографії.
- •Залежність форми кривих поглинання від виду адсорбції.
- •Йонообмінна хроматографія. В основі лежить процес йонного обміну
- •Тонкошарова хроматографія
- •Радіальна хроматографія
- •Хроматографія на папері.
- •Газова хроматографія (гх).
- •Заняття№15
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Заняття 16
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9 Дисперсні системи
- •Класифікація за ступенем дисперсності подідяють:
- •Класифікація дисперсних систем за агрегатним станом
- •Молекулярно-кінетичні властивості колоїдних систем
- •Оптичні властивості колоїдних систем.
- •Явища, що супроводжують коагуляцію.
- •Коагуляція в біологічних системах.
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 10 Розділ 9. Високомолекулярні сполуки
- •Контрольні питання.
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Розділ 11 класифікація і номенклатура органічних сполук. Реакційна здатність алканів, алкенів, аренів.
- •Теорія будови органічних сполук а.М. Бутлерова:
- •Класифікація органічних сполук
- •Основні класи органічних сполук
- •Номенклатура органічних сполук
- •Класифікація реакцій в органічній хімії
- •Насичені вуглеводні (алкани)
- •Гомологічний ряд алканів
- •Будова молекули Метану
- •Ізомерія
- •Фізичні властивості
- •Хімічні властивості
- •Ненасичені вуглеводні (Алкени, алкадієни, алкіни)
- •Алкени. Гомологічний ряд алкенів.
- •Електронна будова подвійного зв’язку
- • Подвійний зв’язок – це ковалентний зв’язок, який складається з одного - і одного π-зв’язку. Подвійному зв’язку відповідає sp2- гібридизація. Ізомерія
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Алкадієни.
- •Хімічні властивості алкадієнів
- •Електронна будова потрійного зв’язку
- • Потрійний зв’язок – це ковалентний зв’язок, який складається з одного - і двох π- звязків. Потрійному зв’язку відповідає sp гібридизація. Фізичні властивості алкінів
- •Хімічні властивості
- •I. Реакції приєднання:
- •Ароматичні вуглеводні (арени)
- •Будова молекули бензолу (бензену)
- •Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1) Гідрування:
- •2) Галогенування
- •Правила орієнтації в бензольному ядрі
- •Заняття 21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Заняття №22.
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Розділ 12 оксигенвмісні органічні сполуки
- •Спирти.
- •Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Заняття 23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті.
- •Одержання
- •Гідратація алкінів: Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •4) Реакції полімеризації:
- •Реакції поліконденсації
- •Застосування
- •Заняття 24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •Дикарбоновимі кислотами називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи.
- •Естери (складні ефіри) – це сполуки, що складаються із залишку карбонової кислоти і спирту.
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Заняття 25.
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Методика виконання роботи
- •Розділ 15 дослідження хімічних властивостей моно- і полісахаридів.
- •Значення
- •Моносахариди. Будова. Ізомерія
- •Класифікація
- •Генетичний d- ряд сахаридів
- •Формули хеуорса
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •I. Реакції по карбонільній групі
- •1. Окиснення (для альдегідів)– призводить до утворення відповідних кислот.
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Класифікація і номенклатура
- •Застосування
- •Полісахариди
- •Крохмаль Будова молекули (розгалужений ланцюг)
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •Целюлоза (клітковина) Будова молекули (лінійний ланцюг)
- •Знаходження в природі
- •Застосування
- •Заняття № 26
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Розділ 16 дослідження реакційної здатності гетерофункціональних сполук. Амінокислоти
- •Найважливіші представники гідроксикислот.
- •Амінокислоти
- •Класифікація амінокислот.
- •Класифікація α-амінокислот
- •Ізомерія
- •Фізичні властивості
- •Одержання амінокислот
- •Хімічні властивості
- •Біполярний йон
- •Пептиди. Білки
- •Склад і будова молекули
- •Поширення в природі
- •Хімічні властивості
- •Заняття 28
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Заняття 29 Тема: α-Амінокислоти, пептиди, білки.
- •3. Конкретні цілі,вміти:
- •Самостійна робота на занятті..
- •Гетероциклічні сполуки Класифікація гетероциклів
- •Номенклатура гетероциклічних сполук
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли Властивості і реакції шестичленних гетероциклічних сполук
- •2 Окиснення піридину і алкілпіридинів
- •Шестичленні гетероциклічні сполуки з двома гетероатомами
- •Біциклічні гетероцикли
- •Розділ 18 нуклеїнові кислоти
- •Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти.
Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
 звідки
звідки

Метод визначення молярної маси сполук за зниженням температури замерзання називається кріоскопією, відповідно за підвищенням температури кипіння - ебуліоскопією.
Визначення депресії біологічних рідин (крові, лімфи, сечі) дає можливість розрахувати їх "осмотичну" концентрацію, тобто сумарну концентрацію всіх частинок, які неможливо визначити звичайними методами кількісного аналізу.
Для розчинів неелектролітів, які перебувають у вигляді молекул осмотична концентрація дорівнює молярній.
Сосм. = С мол.
Осмотичний тиск можна визначити за експериментальною депресією:

де R = 8,314 Дж/моль *К
К=1,86
Для розчинів електролітів, які містять суміш дисоційованих йонів.
Сосм=іСм
де і=1+α(п-1)
і- ізотонічний коефіцієнт;
п - число продисоційованих частинок;
α- ступінь дисоціації.
Більш
точно осмотичний тиск можна визначити
експериментально за депресією температури
плавлення:

Отже, осмотичний тиск визначають за формулою:

Заняття №9
Тема: Колігативні властивості розчинів. Осмос і осмотичний тиск.
Актуальність теми: Осмос має важливе значення для рослинних і тваринних організмів, створюючи необхідні умови для нормального протікання біофізичних і біохімічних процесів. В людському організмі необхідне постійне значення осмотичного тиску крові і інших біологічних рідин. Значення осмотичних властивостей розчинів, їх залежність від різних речовин, робить можливим регулювання і підтримання необхідних параметрів стану організму.
Навчальні цілі:
Знати: залежність осмотичного тиску від концентрації розчинених електролітів і неелектролітів. Знати осмотичний тиск різних біологічних рідин і вплив на нього різних факторів.
Вміти: визначати і розраховувати осмотичний тиск розчинів і основних біологічних рідин.
Самостійна позааудиторна робота студентів
Обчислити осмотичний тиск розчину глюкози з концентрацією 0,287 моль/л.
Контрольні питання
Дифузія в розчинах і її значення для біологічних систем.
Закон Фіка.
Осмос і осмотичний тиск.
Закон Вант-Гоффа для осмотичного тиску.
Осмотичні властивості розчинів неелектролітів.
Осмотичні властивості розчинів електролітів. Коефіцієнт Вант-Гоффа.
Гіпер-, гіпо- і ізотонічні розчини.
Процеси плазмолізу і гемолізу.
Дайте визначення поняттю дифузія, осмотичний тиск, ізотонічний коефіцієнт, осмос, осмотична концентрація.
Приклад завдань для тестового контролю:
1. Дифузія – це процес:
а) переходу речовини із твердого стану в рідкий;
б) переміщення частинок речовини з зони меншої концентрації в більшу до вирівнювання концентрації;
в) переміщення частинок речовини з зони більшої концентрації в меншу до вирівнювання концентрації;
г) переходу речовини із рідкого стану в газоподібний;
д) переходу речовини із одного стану в інший;
2 Кількісно величину осмотичного тиску розчиненого у воді неелектроліту можна визначити законом Вант-Гоффа за формулою:
а) б) π=iCRT в) Δp=po x2 г) π=CRT
д)
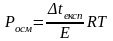
3. Еритроцит вміщений в 10 % розчин NaCl. При цьому протікає процес:
а) плазмолізу; б) гемолізу; в) ендосмосу; г) не проходить; д) дифузії.
4. Розчин NaCl при 310 К має осмотичний тиск 750 кПа. Скільки грамів солі міститься в 200 г такого розчину?
а) 3,4 г; б) 1,7 г; в) 0,85 г; г) 0,95; д) 3,5 г.
