
- •Техніка безпеки при роботі в лабораторії.
- •Перша допомога.
- •Розділ і Біогенні s- та р-елементи, біологічна роль, застосування в медицині
- •Вміст у організмі та значення для організму макроелементів
- •Якісна реакція на катіони лужних металів - фарбування полум'я в наступні кольори:
- •Загальні хімічні властивості
- •Біологічна роль та застосування в медицині s та р – елементів
- •Заняття №1 Тема: Біогенні s-елементи; біологічна роль, застосування в медицині.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Заняття №2
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •3.Фізичні властивості :
- •4. Хімічні властивості d-елементів і їх сполук виходячи з будови атомів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання:
- •Приклад завдань для тестового контролю:
- •Методика виконання лабораторної роботи
- •Розділ 3 Комплексні сполуки
- •Класифікація та номенклатура комплексних сполук
- •Хімічний зв’язок у комплексних сполуках
- •Заняття №4
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Розділ 4 Вчення про розчини. Кислотно-основна рівновага біологічних рідин в організмі
- •Приклади розв’язування задач за темою «Розчини»
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 5. Розчини електролітів
- •Слабкі електроліти.
- •Сильні електроліти.
- •Теорія кислот і основ.
- •Дисоціація води.
- •Гідроліз солей. Ступінь та константа гідролізу
- •Буферні розчини.
- •Біохімічні буферні системи.
- •Самостійна позааудиторна робота студентів.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 7
- •Основні поняття:
- •1Г вуглеводів 19,6 кДж
- •Хімічний склад і калорійність харчових продуктів
- •Задача 3
- •Задача 4
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
- •Розділ 8. Хімічна кінетика
- •Залежність швидкості реакції від різних факторів.
- •Теорія активних комплексів.
- •Теорії каталізу
- •Ферментативний каталіз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9
- •Гальваноз.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •1 Правило: Кристалічну гратку адсорбенту добудовують ті йони, що входять до її складу, ізоморфні з її йонами, утворюють з йонами цієї гратки важкорозчинні сполуки.
- •2 Правило: На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду яких протилежний знаку заряду поверхні адсорбенту.
- •Типи хроматографії.
- •Залежність форми кривих поглинання від виду адсорбції.
- •Йонообмінна хроматографія. В основі лежить процес йонного обміну
- •Тонкошарова хроматографія
- •Радіальна хроматографія
- •Хроматографія на папері.
- •Газова хроматографія (гх).
- •Заняття№15
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Заняття 16
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 9 Дисперсні системи
- •Класифікація за ступенем дисперсності подідяють:
- •Класифікація дисперсних систем за агрегатним станом
- •Молекулярно-кінетичні властивості колоїдних систем
- •Оптичні властивості колоїдних систем.
- •Явища, що супроводжують коагуляцію.
- •Коагуляція в біологічних системах.
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Приклад завдань для тестового контролю:
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Розділ 10 Розділ 9. Високомолекулярні сполуки
- •Контрольні питання.
- •Самостійна робота на занятті
- •Методика виконання роботи
- •Розділ 11 класифікація і номенклатура органічних сполук. Реакційна здатність алканів, алкенів, аренів.
- •Теорія будови органічних сполук а.М. Бутлерова:
- •Класифікація органічних сполук
- •Основні класи органічних сполук
- •Номенклатура органічних сполук
- •Класифікація реакцій в органічній хімії
- •Насичені вуглеводні (алкани)
- •Гомологічний ряд алканів
- •Будова молекули Метану
- •Ізомерія
- •Фізичні властивості
- •Хімічні властивості
- •Ненасичені вуглеводні (Алкени, алкадієни, алкіни)
- •Алкени. Гомологічний ряд алкенів.
- •Електронна будова подвійного зв’язку
- • Подвійний зв’язок – це ковалентний зв’язок, який складається з одного - і одного π-зв’язку. Подвійному зв’язку відповідає sp2- гібридизація. Ізомерія
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Алкадієни.
- •Хімічні властивості алкадієнів
- •Електронна будова потрійного зв’язку
- • Потрійний зв’язок – це ковалентний зв’язок, який складається з одного - і двох π- звязків. Потрійному зв’язку відповідає sp гібридизація. Фізичні властивості алкінів
- •Хімічні властивості
- •I. Реакції приєднання:
- •Ароматичні вуглеводні (арени)
- •Будова молекули бензолу (бензену)
- •Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1) Гідрування:
- •2) Галогенування
- •Правила орієнтації в бензольному ядрі
- •Заняття 21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Заняття №22.
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Розділ 12 оксигенвмісні органічні сполуки
- •Спирти.
- •Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Заняття 23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті.
- •Одержання
- •Гідратація алкінів: Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •4) Реакції полімеризації:
- •Реакції поліконденсації
- •Застосування
- •Заняття 24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •Дикарбоновимі кислотами називають похідні вуглеводнів, які містять в своєму складі дві карбоксильні групи.
- •Естери (складні ефіри) – це сполуки, що складаються із залишку карбонової кислоти і спирту.
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Заняття 25.
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Методика виконання роботи
- •Розділ 15 дослідження хімічних властивостей моно- і полісахаридів.
- •Значення
- •Моносахариди. Будова. Ізомерія
- •Класифікація
- •Генетичний d- ряд сахаридів
- •Формули хеуорса
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •I. Реакції по карбонільній групі
- •1. Окиснення (для альдегідів)– призводить до утворення відповідних кислот.
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Класифікація і номенклатура
- •Застосування
- •Полісахариди
- •Крохмаль Будова молекули (розгалужений ланцюг)
- •Фізичні властивості
- •Хімічні властивості
- •Знаходження в природі
- •Застосування
- •Целюлоза (клітковина) Будова молекули (лінійний ланцюг)
- •Знаходження в природі
- •Застосування
- •Заняття № 26
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Розділ 16 дослідження реакційної здатності гетерофункціональних сполук. Амінокислоти
- •Найважливіші представники гідроксикислот.
- •Амінокислоти
- •Класифікація амінокислот.
- •Класифікація α-амінокислот
- •Ізомерія
- •Фізичні властивості
- •Одержання амінокислот
- •Хімічні властивості
- •Біполярний йон
- •Пептиди. Білки
- •Склад і будова молекули
- •Поширення в природі
- •Хімічні властивості
- •Заняття 28
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Заняття 29 Тема: α-Амінокислоти, пептиди, білки.
- •3. Конкретні цілі,вміти:
- •Самостійна робота на занятті..
- •Гетероциклічні сполуки Класифікація гетероциклів
- •Номенклатура гетероциклічних сполук
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли Властивості і реакції шестичленних гетероциклічних сполук
- •2 Окиснення піридину і алкілпіридинів
- •Шестичленні гетероциклічні сполуки з двома гетероатомами
- •Біциклічні гетероцикли
- •Розділ 18 нуклеїнові кислоти
- •Рибонуклеїнові (рнк) і дезоксирибонуклеїнові (днк) кислоти.
Теорія кислот і основ.
Теорія електролітичної дисоціації С.Арреніуса (1883), була першою науково обгрунтованою теорією розчинів, згідно з якою, кислотами є сполуки в розчинах яких присутні йони Н+, а основи – ОН-. Однак розвиток науки показав, що існують речовини, особливо лікарські речовини (фенобарбінтал, сульфадімезин), які проявляють кислотні властивості, а при дисоціації не утворюють вільних Н+. Крім того доведено, що у водних розчинах Н+ не бувають у вільному вигляді, а у вигляді йону: Н+ + Н2О = НзО+
Сучасні уявлення про природу кислот і основ дали Дж. Бренстед та І.Льюїс (1923р). Згідно їх теорії, яка називається протонною, кислота - це речовина, що віддає протон (донор протону), а основа - речовина, що приймає протон (акцептор протона).
Так наприклад при взаємодії води з гіпохлоритною кислотою:
 НClО
+ Н2О
СlO-
+ H3O+
НClО
+ Н2О
СlO-
+ H3O+
супряжена супряжена супряжена супряжена
кислота основа основа кислота
І II І II
Кислоту і основу називають супряженою парою і кислотні властивості речовини можуть проявлятись тільки в присутності основи (акцептора протона), а основні властивості - в присутності кислоти (донора електронів).
Такі погляди на кислоти і основи дали можливість систематизувати багато хімічних реакцій. В першу чергу - це реакції гідролізу і нейтралізації. Так процес гідролізу за Бренстедом пояснюється тим, що один із видів йонів цих солей підлягає протолізу:
Наприклад гідроліз соди (натрій карбонату) електролітична дисоціація:
Nа2СОз = 2 Nа+ + СОз2-
протоліз аніону слабкої кислоти: СОз2- + Н2О = НСОз- + ОН-
надлишок групи ОН- свідчить, що розчин буде лужним.
Реакція нейтралізації по Бренстеду характеризується процесами:
протоліз НС1+ Н2О = С1-+Н3О+
електролітична дисоціація NаОН = Nа+ + ОН- нейтралізація: Н3О+ + ОН- = 2Н2О
Отже, згідно сучасних уявлень, кислота - це акцептор пари електронів, а основа - донор електронів. (теорія Льюїса)
Дисоціація води.
Згідно з теорією Бренстеда вода відносно самої себе є одночасно і кислотою і основою (амфоліт)
Н2О =ОН-+Н+ Н2О + Н+ = Н3О+ Н2О + Н2О = Н3О+ + ОН-
ця реакція називається автопротолізом води: кількісно автопротоліз визначається йонним добутком води.
Константи рівноваги К=3,24.10-18 при 290 К
К=1,84 .10-16 при 273 К

Оскільки ступінь дисоціації води дуже низький (з 550 млн. молекул води -дисоціює тільки одна), то її концентрацію можна вважати постійною і рівною масі 1 л води при 25°С 998,07 г, поділеній на молярну масу води

Обчисливши скільки молей води є в 1 л її ( при 0°С)

можна розрахувати добуток концентрації
[H3O+].[OH-]=K.[H2O]2 1,84.10-16.55,52=
1.10-14
1,84.10-16.55,52=
1.10-14
Отже рівняння [H3O+].[OH-]=1.10-14 йонний добуток води.
Це величина постійна, яка все ж залежить від температури. Для прикладу при 100°С йонний добуток води зростає в 100 разів в порівнянні з тим, що при 18оС і стає 10-12.
Йонний добуток води має надзвичайно важливе практичне значення.
В
нейтральному розчині коли
[H3O+]=[OH-]= -
ця величина постійна.
-
ця величина постійна.
В кислому середовищі, коли [H3O+]>[OH-] можна сказати, що[H3O+]>10-7, а [OH-] <10-7
В лужному середовищі[H3O+]<10-7, а [OH-] >10-7
Те, що йонний добуток води є величина постійна дає можливість знаючи концентрацію одного з йонів обчислювати концентрацію іншого.
Наприклад, якщо відомо що в розчині [Н3О+] = 10-3 моль/л, то це значить, що середовище розчину кисле, а концентрація
[
ОН-]
=
Для зручності розрахунків реакцію середовища водного розчину характеризують водневим показником рН.
Водневий показник рН - це десятковий логарифм активності йонів гідроксонію, взятий з від’ємним знаком.
 або
або
pH=-lg[H3O+]
Аналогічно рОН-= -lg[OH-]
Оскільки активності йонів в чистій воді дорівнюють їх концентраціям, а= с, то можем записати, що рКводи=рН + рОН-=14
Наприклад, якщо відомо, що розчин НС1 має концентрацію 0,01 моль/л, і знаючи що це сильна кислота і дисоціює повністю на йони [ Н3О+] = c HCl і значить
[Н3О+] = 10-2 моль/л, рН = 2, а pОН-= 14 - 2 = 12
Для розчину NаОН з См = 0,001 моль/л [ОН-] = 10-3, тобто pОН- = 3, а pН = 14 - 3 =11.
Для Н2SO4 в якої молярна концентрація еквівалентів 0,002 моль/л
рН=-lg2.10-3=3-lg 2=2,7 pOH=14-2,7=11,3
Для розчинів слабких кислот і основ, в яких кількість йонів значно менша за концентрацію кислоти чи основи треба знати значення ступеня або константи йонізації.
рН=-lg c .α
або
згідно з законом Освальда
 тоді
тоді

де Ка - константа йонізації ( в "Довіднику хіміка");
с - концентрація.
Аналогічно
для слабких основ рОН=-lg
c
.α

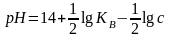
Отже, для розчину СН3СООН з См =0.1 моль/л

Водневий показник рН використовується дуже широко при біохімічних дослідженнях, а також у клінічній фармакологічній практиці. Постійність концентрації водневих йонів є однією із істотних констант внутрішного середовища організму. При цьому відомо, що різні фізіологічні рідини людини мають різні значення рН
-
Рідини
Імовірне значеня рН
Можливі границі
Кров (плазма)
7.36
7.36-7.45
Шлунковий сік
1.65
0.9-2.00
Кишковий сік
6.51
5.07 - 7.07
Сеча
5.8
5.0-6.5
Піт
7.4
4.2-7.8
Слина
6.75
5.6-7.9
Спинно-мозкова рідина
7.7
7.55-7.8
Сльозова рідина
7.7
7.6-7.8
Це свідчить про те, що різні біологічні ферменти є активними тільки при певних значеннях рН.
Зміщення реакції середовища в організмі в сторону кислого середовища називається ацидозом, а в сторону лужного - алкалозом.
Зміна реакції крові на декілька десятих долей рН приводить до серйозних порушень життєдіяльності. Визначення концентрації водневих йонів дозволяє визначити характер патологічних процесів, що протікають в організмі.
Визначення рН середовища має важливе значення і в різних фізіологічних рідинах може бути досить складним. Сучасний розвиток приладобудування дозволяє мати прилади, які визначають досить точно рН -розчину, що є важливим інструментом для медика.
