
- •Біонеорганічна хімія Методична вказівка для студентів до практичного заняття з хімії Заняття 1
- •Базові знання, вміння, навички, необхідні для вивчення теми
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Методика виконання лабораторної роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 2
- •Базові знання, вміння, навички, необхідні для вивчення теми
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті.
- •Методика виконання лабораторної роботи
- •Література
- •Базові знання, вміння, навички, необхідні для вивчення теми
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 4
- •Самостійна позааудиторна робота студентів
- •Контрольні питання.
- •Самостійна робота на занятті
- •Методика виконання лабораторної роботи
- •Література
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 5
- •Самостійна позааудиторна робота студентів
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Оформлення протоколу здійснюється за схемою:
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 6
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 7
- •Самостійна поза аудиторна робота студентів.
- •Контрольні питання:
- •Самостійна робота на занятті.
- •Методика виконання роботи.
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 8
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 9
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття № 10 Тема: «Диференційований залік (Біонеорганічна хімія)»
- •Самостійна позааудиторна робота
- •Література:
- •Фізична і колоїдна хімія Методична вказівка для студентів до практичного заняття з хімії Заняття 11
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •Різниця цих рівнянь і дасть рівняння утворення кристалогідрату
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття №13 Тема: Розчини електролітів. Електроліти в організмі людини. Електропровідність розчинів: питома, молярна, гранична.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання.
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття №14
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Методика виконання роботи
- •ЛІтературА
- •Методична вказівка для студентів до практичного заняття з хімії Заняття №15
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті.
- •Методика виконання роботи
- •ЛІтературА
- •Іі семестр Методична вказівка для студентів до практичного заняття з хімії заняття №16
- •Методична вказівка для студентів до практичного заняття з хімії заняття №17
- •Література
- •Методична вказівка для студентів до практичного заняття з хімії заняття №18
- •Методична вказівка для студентів до практичного заняття з хімії заняття № 19
- •Методична вказівка для студентів до практичного заняття з хімії Заняття № 20 Тема:«Диференційований залік (Фізична і колоїдна хімія)»
- •Література:
- •Біоорганічна хімія. Методична вказівка для студентів до практичного заняття з хімії Заняття 21
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Література:
- •Правила номенклатури
- •Методична вказівка для студентів до практичного заняття з хімії Заняття №22.
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Література
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 23
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті.
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 24
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 25
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Методика виконання роботи
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття № 26
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття №27
- •Самостійна позааудиторна робота
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 28
- •Самостійна позааудиторна робота:
- •Контрольні питання.
- •Самостійна аудиторна робота.
- •Література:
- •Методична вказівка для студентів до практичного заняття з хімії Заняття 29
- •3. Конкретні цілі,вміти:
- •Самостійна робота на занятті..
- •Методична вказівка для студентів до практичного заняття з хімії Заняття № 30
- •Самостійна позааудиторна робота
- •Література:
Контрольні питання.
1. Напишіть вираз:
а) константи рівноваги;
б) швидкості прямої і зворотної реакції.
Для реакцій:
СО2(г) + С(тв) =СО (г) N2 + O2 = 2NO
N2 + 3H2 = 2NH3 CO(г) + H2O(г) = CO2(г) + H2
2SО2(г) + О2(г) = 2SО3 (г) 2NO2 = 2NO +O2
2NO + Cl2 =2NOCl 2СО + О2 = 2СО2
2Н2 + О2 = 2H2O(г) 2NO + О2 = 2NO2
С(тв) + Н2О (г) = СО + Н2 2N2O + O2 = 4NO
2. Як зміниться швидкість даної реакції, якщо:
а) концентрацію одного з компонентів збільшити в два рази;
б) тиск системи зменшити в три рази;
в) температуру підвищити з 650 до 720 К (температурний коефіцієнт 2).
Самостійна робота на занятті.
Виконати лабораторні роботи.
Визначення залежності швидкості хімічної реакції від концентрації
Визначення залежності швидкості хімічної реакції від каталізатора.
Методика виконання роботи
Робота 1. Залежність швидкості реакції від концентрації реагуючих речовин.
В 5 пробірок послідовно налити по 0,5; 1,0; 1,5; 2,0; 2,5 мл 0,1 М розчину тіосульфату натрію. В кожну з перших чотирьох пробірок відповідно долити 2,0; 1,5,; 1,0; 0,5 мл води, а п’ята пробірка залишається без змін. Ці п’ять вихідних розчинів умовно назвемо розчини 1. Окремо в 5 інших пробірок наливають по 2,5 мл 0,1 М розчину сірчаної кислоти. Попарно зливають розчини в 1 і 2. Визначають час до початку помутніння розчину в кожній пробірці. Результати спостережень записують в таблицю.
№ п/п |
Об’єм в мл |
Концентрація вихідного Na2S2O3 |
Час помутніння |
||
H2SO4 |
H2O |
Na2S2O3 |
|||
1 |
0,5 |
2,0 |
0,5 |
|
|
2 |
0,5 |
1,5 |
1,0 |
|
|
3 |
0,5 |
1,0 |
1,5 |
|
|
4 |
0,5 |
0,5 |
2 |
|
|
5 |
|
0 |
2,5 |
|
|
За результатами досліду розраховують концентрації одержаних вихідних розчинів тіосульфату натрію в кожній з пробірок за формулою. Малюють графік залежності в координатах: концентрації тіосульфату – час помутніння. На основі цього зробити висновок залежності швидкості реакції від концентрації тіосульфату натрію.
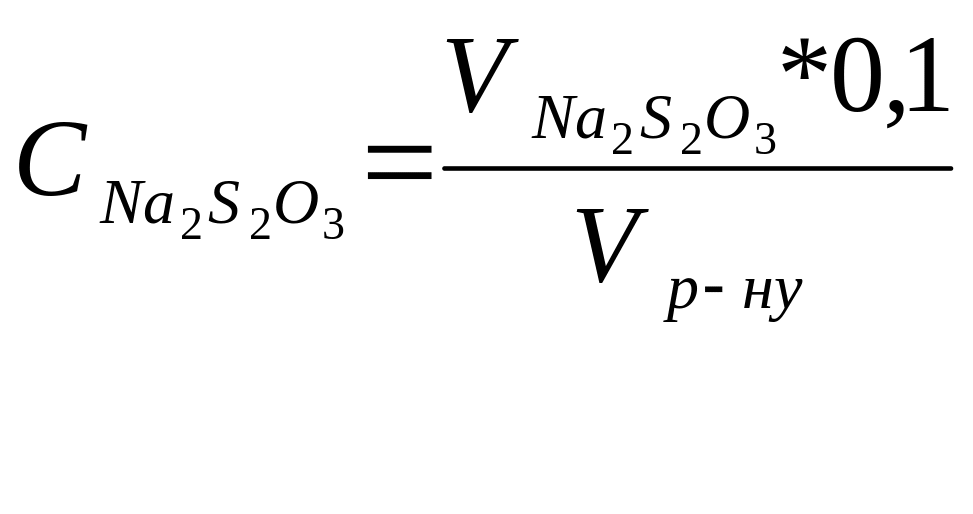
Робота 2. Залежність швидкості реакції від наявності каталізатора.
В дві пробірки окремо наливають по 2 мл 0,1 М розчину тіосульфату натрію, в інші дві пробірки – по 2,5 мл 0,5 М розчину сірчаної кислоти. В одну із пробірок з тіосульфатом натрію приливають 0,5 мл, 0,05 М розчину сульфату міді (каталізатор), а в другу – 0,5 мл води.
Розчини попарно зливають і спостерігають за часом помутніння в кожній пробірці. Вказати дію каталізатора (прискорює чи сповільнює дану реакцію).
