
- •Вопрос 1.Классификация неорганических веществ
- •Вопрос 2. Классификация, получение и свойства оксидов
- •Вопрос 3. Классификация, получение и свойства кислот
- •4 Классификация, получение и свойства оснований
- •5.Классификация, получение и свойства солей
- •6.Номенклатура солей. Название кислых, средних и основных солей
- •7.Основные законы химии
- •8.Химический эквивалент
- •9.Закон эквивалентов и следствия из него. Применение закона для реакций с участием газов и реакций ионного обмена в водных растворах.
- •10.Ядерная модель строения атома Резерфорда. Строение ядра атомов. Изотопы и изобары
- •Вопрос 28
- •Вопрос 33 Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
- •Вопрос 37. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции от температуры .
- •Вопрос 38. Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
- •Вопрос 40. Принцип Ле-Шателье:
- •Вопрос 42
- •Вопрос 43.
- •Вопрос 44. Первый закон термодинамики
- •Вопрос 47 Энтропия – это одна из функций состояния
- •Вопрос 51 Массовая доля растворённого вещества w(b) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
- •Вопрос 53
- •Вопрос 59.
- •Вопрос 60.
- •Вопрос 68. Растворимостью вещества называют способность ее растворяться в той или иной среде. (Раствори́мость — способность вещества образовывать с другими веществами однородные системы ).
- •Вопрос 70.
- •Вопрос 72. Реакция ионного обмена — реакции между двумя сложными веществами- электролитами в растворах, в результате
- •Вопрос 74. .Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
- •Вопрос 75. Различные случи солей гидролиза..
- •Вопрос 76. Вопрос 77. Степень гидролиза[править | править исходный текст]
- •1.1 Характеристики гидролиза
Вопрос 1.Классификация неорганических веществ
.Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.Неорганические вещества:Простые: Металлы, НеметаллыСложные: Оксиды, Основания, Кислоты, СолиРезкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.С - алмаз, графит, карбин.O - кислород, озон.S - ромбическая, моноклинная, пластическая.P - белый, красный, чёрный.Явление аллотропии вызывается двумя причинами:1) различным числом атомов в молекуле, например кислород O2 и озон O32) образованием различных кристаллических форм, например алмаз и графит.
Вопрос 2. Классификация, получение и свойства оксидов
Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2.
Химические свойства
Основные оксиды
1. Основный оксид + сильная кислота → соль + вода
![]()
2. Сильноосновный оксид + вода → гидроксид
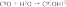
3. Сильноосновный оксид + кислотный оксид → соль

![]()
4. Основный оксид + водород → металл + вода
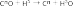
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
![]()
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль
![]()
3. Кислотный оксид + основание → соль + вода
![]()
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
![]()
![]()
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
![]()
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
![]()
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
![]()
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
![]() (в
водном растворе)
(в
водном растворе)
![]() (при
сплавлении)
(при
сплавлении)
Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
![]()
![]()
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:
![]()
![]()
2. Обжиг или горение бинарных соединений в кислороде:
![]()
![]()
![]()
3. Термическое разложение солей:
![]()
![]()
Вопрос 3. Классификация, получение и свойства кислот
Кислотами (кислотными гидроксидами) с позиции теории электролитической диссоциации называются вещества, диссоциирующие в растворах с образованием ионов водорода.
Кислоты классифицируются по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты.
По силе кислоты делятся на сильные и слабые. Важнейшие сильные кислоты – азотная HNO3, серная H2SO4, и соляная HCl.
По наличию кислорода различают кислородсодержащие кислоты (HNO3, H3PO4 и т.п.) и бескислородные кислоты (HCl, H2S, HCN и т.п.).
По основности, т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли, кислоты подразделяются на одноосновные (например, HNO3, HCl), двухосновные (H2S, H2SO4), трехосновные (H3PO4) и т. д.
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания –водородная: HCl – хлороводородная кислота, H2Sе – селеноводородная кислота, HCN – циановодородная кислота.
Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением слова «кислота». При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на «ная» или «овая», например, H2SO4 – серная кислота, HClO4 – хлорная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: «оватая» (HClO3 – хлорноватая кислота), «истая» (HClO2 – хлористая кислота), «оватистая» (HОCl – хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее низшей степени окисления элемента, получает окончание «истая» (HNO3 – азотная кислота, HNO2 – азотистая кислота).
Получение кислот
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом:
H2 + Cl2 → 2HCl,
H2
+ S
![]() H2S.
H2S.
2. Кислородсодержащие кислоты нередко могут быть получены при непосредственном соединении кислотных оксидов с водой:
SO3 + H2O = H2SO4,
CO2 + H2O = H2CO3,
P2O5 + H2O = 2HPO3.
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
BaBr2 + H2SO4 = BaSO4 + 2HBr,
CuSO4 + H2S = H2SO4 + CuS,
CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O.
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:H2O2 + SO2 = H2SO4,
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
Химические свойства кислот
Взаимодействие с основными оксидами с образованием соли и воды:
![]()
Взаимодействие с амфотерными оксидами с образованием соли и воды:
![]()
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
![]()
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если используемая кислота растворима[32]:
![]()
Взаимодействие с солями, если выпадает осадок или выделяется газ:
![]()
Сильные кислоты вытесняют более слабые из их солей:
![]()
![]()
(в данном случае образуется неустойчивая угольная кислота H2CO3 , которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO3 любой концентрации и концентрированной серной кислоты H2SO4), если образующаяся соль растворима:
![]()
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
![]()
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
![]()
Например:
![]()
