
- •Характеристика чистых веществ
- •Тонкослойная хроматография
- •Количественный элементный анализ
- •Физико-химические методы
- •Уф спектроскопия
- •Положение и интенсивность полос поглощения различных типов электронных переходов в уф-спектрах
- •Интенсивность электронных переходов
- •Эмпирические правила вычисления максимумов π π*-полос поглощения в сопряженных системах (правила физера-вудворда)
- •Инфракрасная спектроскопия
- •Ик спектры основных классов органических соединений
- •Функционально замещенные органические соединения
- •Ямр спектроскопия
- •Химический сдвиг
- •Электронное влияние индуктивного и мезомерного эффектов заместителей на величину химического сдвига.
- •Описание спектра
Эмпирические правила вычисления максимумов π π*-полос поглощения в сопряженных системах (правила физера-вудворда)
Вудворд предложил эмпирический метод предсказания батохромного сдвига при алкильном замещении в бутадиене-1,3. Эти правила могут быть сформулированы следующим образом:
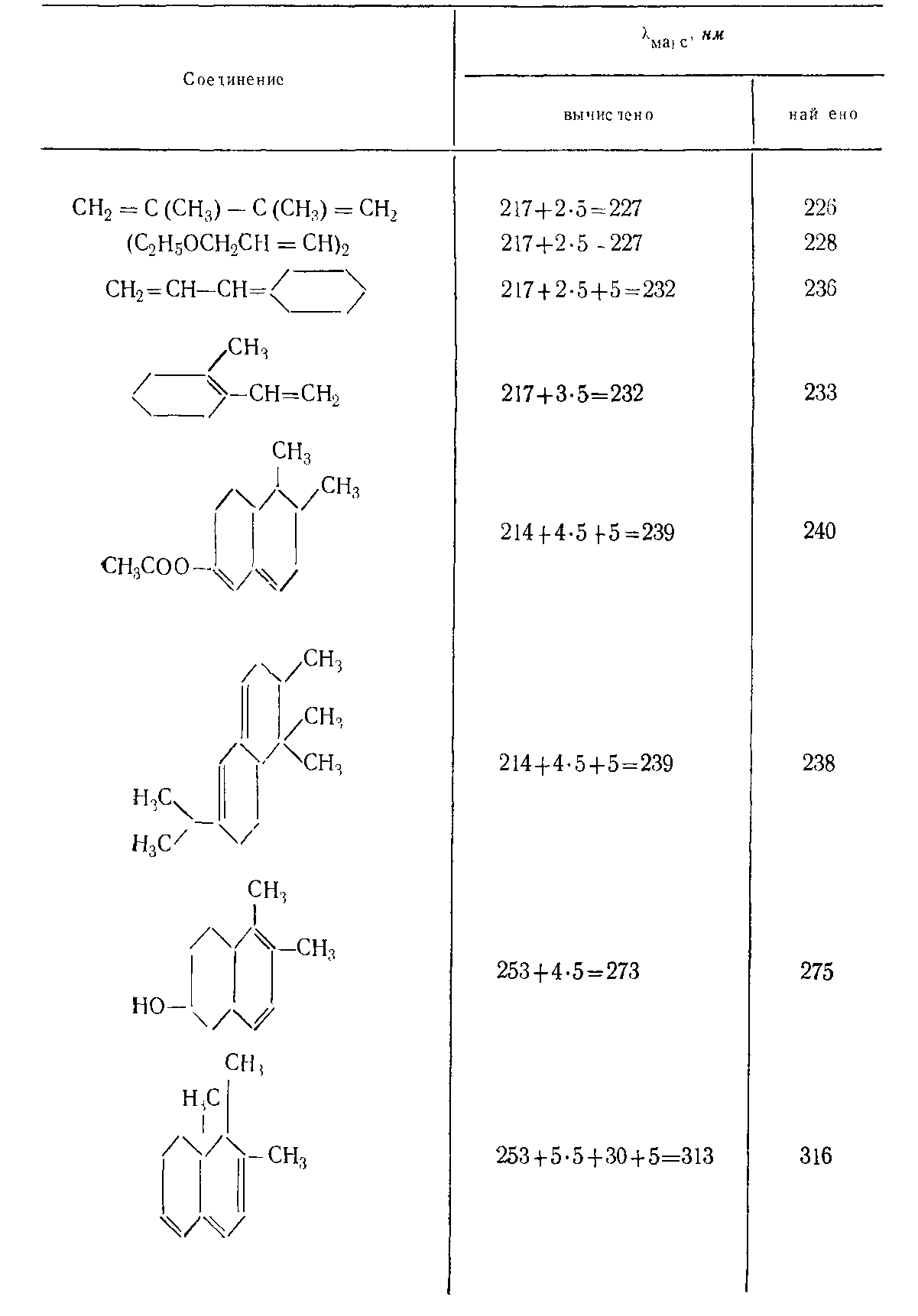
1. Каждая алкильная или циклоалкильная группа, присоединенная к исходному диену (бутадиену-1,3), сдвигает максимум поглощения на 5 нм в длинноволновую область.
2. Возникновение экзоциклической двойной связи приводит к дополнительному батохромному сдвигу на 5 нм, причем, если связь экзоциклична по отношению к двум циклам, сдвиг будет иметь величину 10 нм.
Для расчета выбирается исходная система:
ДИЕНЫ

(Данные не зависят от растворителя)
Таблица – Дополнительные инкрименты заметителей
Структурные особенности замещенных соединений |
Аддитивные сдвиги, нмб |
Расширенная система сопряжения (на каждую двойную связь) |
30 |
Алкильиый заместитель или циклический остаток |
5 |
Экзоцикличсская дпойная связь |
5 |
Полярные группыа |
|
RCO2 |
0 |
RO |
6 |
RS |
30 |
Cl, Br |
17 |
NR2 |
60 |
а R – алкил.
б Все сдвиги положительны.
СОПРЯЖЕННЫЕ КАРБОНИЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
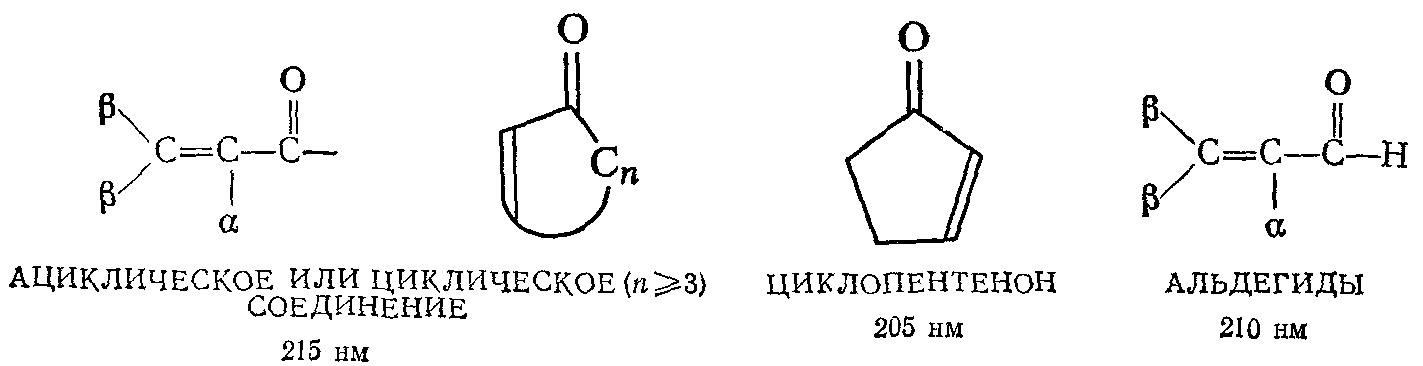
(Данные относятся к спектрам в этаноле; для других растворителей следует вводить указанные в таблице поправки).
Таблица – Дополнительные инкрименты заметителей
Структурные особенности замешенных соединений |
Аддитивные сдвиги, нма |
||
|
|
|
и высшие |
Расширенная система сопряжения (на каждую двойную связь) |
30 |
– |
– |
Гомодиеновый компонент |
39 |
– |
– |
Экзоциклическая двойная связь |
5 |
– |
–- |
Алкильные группы |
10 |
12 |
18 |
ОН |
35 |
30 |
50 |
OR |
35 |
30 |
17 (, +31) |
SR |
|
85 |
|
CH3CO2 |
6 |
6 |
6() |
Cl |
15 |
12 |
|
Br |
25 |
30 |
|
NR2 |
|
95 |
|
Поправки на растворитель |
|
Вода |
– 8 |
Метанол |
0 |
Диоксан |
+ 5 |
Хлороформ |
+ 1 |
Диэтиловый эфир |
+ 7 |
Гексан |
+ 11 |
Циклогсксан |
+ 11 |
а Все сдвиги положительны.
ПРОИЗВОДНЫЕ БЕНЗОЛА
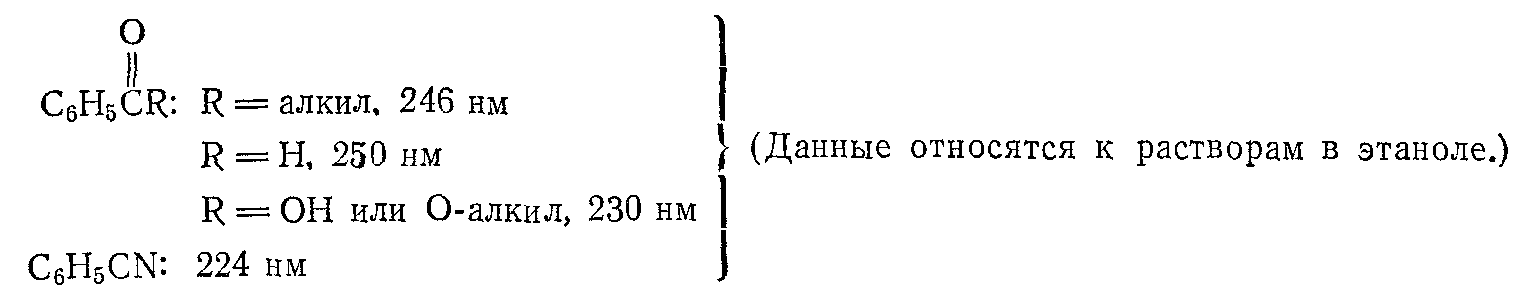
Данные относятся к растворам в этаноле.
Структурные особенности замещенных соединений |
Аддитивные сдвиги, нма |
||
орто |
мета |
пара |
|
Алкильный (или циклический) заместитель |
3 |
3 |
10 |
НО, OR (R – алкил) |
7 |
7 |
25 |
О– |
11 |
20 |
78 |
Cl |
0 |
0 |
10 |
Br |
2 |
2 |
15 |
NH2 |
13 |
13 |
58 |
NHAc |
20 |
20 |
45 |
NHR |
|
|
73 |
NR2 |
20 |
20 |
85 |
а Все сдвиги положительны.
Правила для предсказания поглощения гомо- и гетеро-аннулярных систем связаны главным образом с работой Физера.
Ц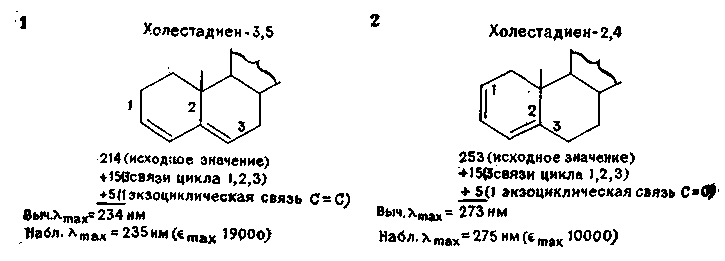 енность
этих правил для структурного исследования
природных соединений очевидна из двух
примеров:
енность
этих правил для структурного исследования
природных соединений очевидна из двух
примеров:
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ. В карбонильных соединениях (альдегиды, кетоны, карбоновые кислоты и их производные) возможны четыре типа переходов: *, n *, n *, *. Карбонильная группа алифатических альдегидов и кетонов поглощает в УФ спектре в двух областях: max 190 ( – 2000, *), вторая полоса обусловлена переходом n * (рис. 12).
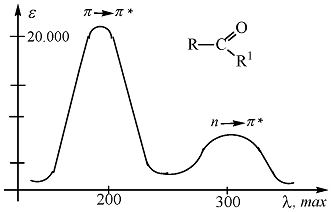
Эта полоса является наиболее характерной и имеет следующие особенности:
а) является наиболее длинноволновой 270-300 нм (наименьшая энергия перехода);
б) имеет низкую интенсивность ( < 100, запрещённый переход);
в) полярные растворители вызывают гипсохромный сдвиг;
г) исчезает в кислой среде вследствие блокирования свободной пары электронов гетероатома за счёт протонирования.
Положение полос карбонильной группы зависит не только от растворителя, но и от природы заместителя в системе R-СО-R1. Увеличение размера углеводородного радикала (или накопление алкильных групп) приводит к батохромному сдвигу и увеличению интенсивности поглощения.
Сопряжённая карбонильная группа даёт интенсивную полосу поглощения в области 205-250 нм (max ~ 10000-20000) и слабую полосу n * перехода при 310-330 нм (max ~ 100 определятся с трудом).
Длинноволновой сдвиг * перехода связан с резким уменьшением его энергии в условиях сопряжения. Для ненасыщенных карбонильных соединений * переход является переходом с переносом заряда и сопровождается изменением дипольного момента:

Поэтому характер УФ спектров таких соединений зависит от растворителя: полярные растворители приводят к батохромному сдвигу полосы * и к гипсохромному сдвигу n * перехода (т.е. к сближению полос поглощения в спектре). Это хорошо видно на примере окиси мезитила:
Полосы поглощения окиси мезитила
Растворитель |
* max, нм |
n * max, нм |
Гептан |
230 |
327 |
Этанол |
237 |
315 |
Вода |
244 |
305 |
Жирные кислоты имеют слабые максимумы в области 205 нм ( 50). Спектры сложных эфиров мало отличаются от спектров соответствующих кислот. Ангидриды, как и галогенангидриды кислот поглощают в более длинноволновой области, по сравнению с кислотами, что можно объяснить влиянием на карбонильную группу заместителей, содержащих неподеленные пары электронов.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ. В аминах наблюдается две полосы поглощения, относящиеся к n * переходу, которые смещаются в длинноволновую часть спектра при увеличении числа заместителей: метиламин (173 и 213 нм), диметиламин (190 и 220 нм), триметиламин (199-227 нм). Присоединение аминогруппы к этиленовой группе вызывает батохромный сдвиг полосы на 40-50 нм и увеличение интенсивности до 20000.
Спектры нитрилов (CN) напоминают спектры соответствующих ацетиленовых соединений, но полосы смещены в коротковолновую область до 100-180 нм. Азосоединения (N=N) имеют малоинтенсивные полосы в видимой ( 20-400) и УФ- (200 нм, 1000) областях.
НИТРОСОЕДИНЕНИЯ. Нитроалканы дают две полосы поглощения: полосу * перехода (200 нм, 50000) и полосу n * перехода (270 нм, 20-40), например, спектр нитрометана:
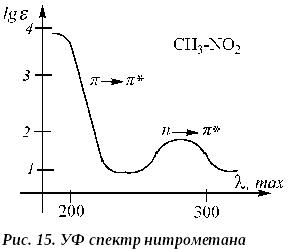
В нитроолефинах полоса * перехода наблюдается в интервале 220-250 нм ( 10000). В нитробензоле:
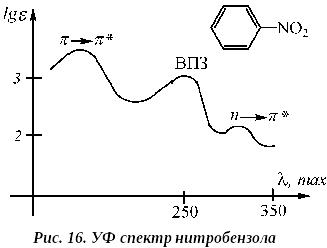
n * переходу соответствует поглощение при 330 нм ( 125). Полоса при 260 нм ( 8000) соответствует переходу с переносом заряда (ВПЗ) от бензольного кольца к нитрогруппе.
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ. Легко идентифицируются по УФ спектрам поглощения. В УФ спектре бензола наблюдается три полосы: E1 – при 180 нм ( 60000), Е2 – при 203 нм ( 8000), В – самая длинноволновая с хорошо выраженной колебательной структурой в области 230-260 нм с максимумом поглощения при 256 нм ( 200) являющаяся наиболее характерной, так называемой полосой бензольного поглощения:
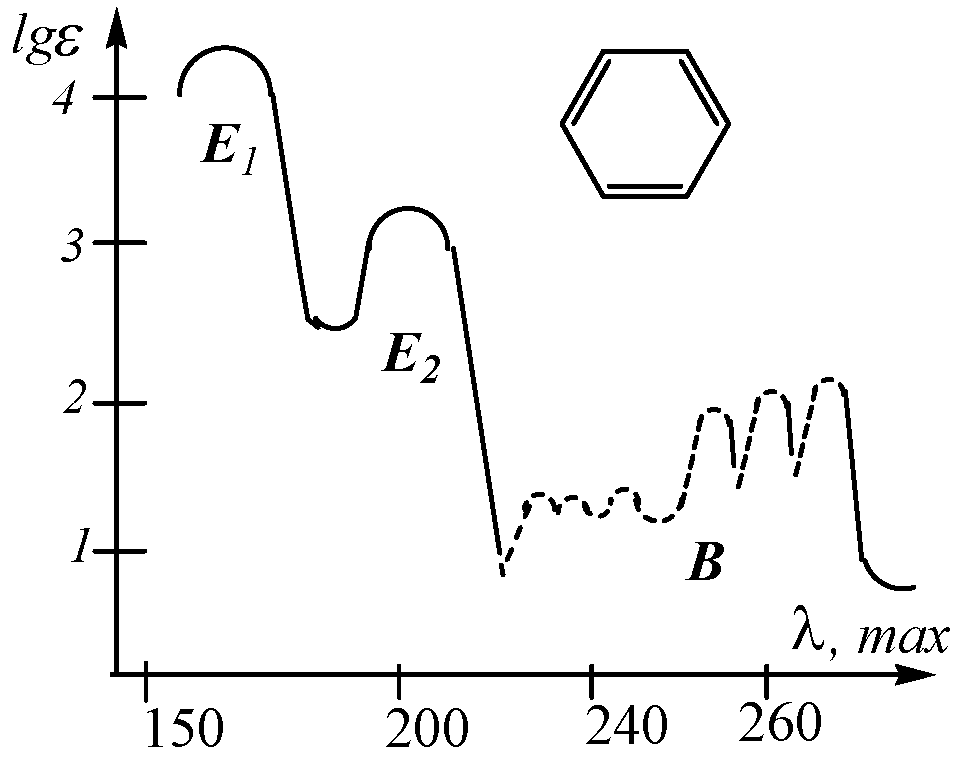
Две последние полосы являются запрещенными для высокосимметричных молекул, поэтому их интенсивность невелика (особенно длинноволновой В-полосы). Тем не менее, именно эта полоса наиболее характерна для бензольного хромофора. Отличительной чертой этой полосы является наличие тонкой структуры, обусловленной взаимодействием с колебательными уровнями энергии. Введение в бензольное кольцо алкильных заместителей, галогенов или заместителей, несущих кратные связи или свободную пару электронов приводит к батохромному сдвигу. Это связано со способностью атомов заместителей к р- сопряжению (или сверхсопряжению) за счёт взаимодействия электронной системы бензольного кольца со свободной парой гетероатома. При этом исчезает тонкая структура B-полосы, а её интенсивность возрастает. Наличие этой полосы резко отличает бензол (алкилбензолы) от сопряженных триеновых систем типа

Присоединение к бензольному кольцу хромофора (ненасыщенной группировки: винильной, карбонильной, нитрогруппы и т.д.) способствует сильному батохромному сдвигу B-полосы (с 250 до 280 нм).
Для акцепторной группы С=О в ароматической системе
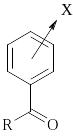
Скоттом была получена эмпирическая шкала, позволяющая рассчитать положение полосы ВПЗ в зависимости от характера и положения заместителя Х. Для расчета длины волны за основу берется 0 в зависимости от заместителя R (R – Alk, = 246 нм; R – OH или R – OAlk, = 230 нм; R – H, = 250 нм) и к ней прибавляются инкрименты заместителя Х:
Таблица – Инкрименты заместителей в системе C6H5-X (правило Скотта)
Х |
Alk |
-OH, -OR |
O- |
С1- |
Вг- |
-NH2 |
-NHCOCH3 |
-N(CH3)3 |
орто- |
3 |
7 |
11 |
0 |
2 |
11 |
20 |
20 |
мета- |
3 |
7 |
20 |
0 |
2 |
11 |
20 |
20 |
пара- |
10 |
25 |
78 |
10 |
15 |
58 |
45 |
85 |
Например, для замещенного бензола:
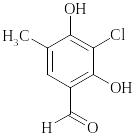
Можно рассчитать длину волны: расч. = 250 + 7 + 5 + 25 = 285 нм, эксп. = 287 нм.
Для дизамещенных производных ароматического ряда наибольшее смещение полосы бензольного поглощения в длинноволновую область происходит в случае пара-расположения имеющихся заместителей.
На характер полосы поглощения оказывает большое влияние пространственный фактор. Например, для дифенила характерна сравнительно интенсивная полоса поглощения max 259 ( = 19000), которая маскирует нормальную полосу -электронной системы бензола с max 254 нм ( = 204). Замещение в о-положении затрудняет сопряжение между двумя кольцами системы и спектр становится аналогичным спектру монозамещенного бензола.
Если в бензольной системе цепь сопряжения растет, то батохромный сдвиг полосы поглощения происходит тем больше, чем длиннее цепь сопряжения. В таких соединениях происходит сдвиг полосы поглощения из УФ области в видимую и как результат – соединение приобретает окраску.
Таким образом, местоположение и интенсивность полосы поглощения ароматических соединений зависит от характера и расположения заместителей в кольце и от величины цепи сопряжения.
