
- •Характеристика чистых веществ
- •Тонкослойная хроматография
- •Количественный элементный анализ
- •Физико-химические методы
- •Уф спектроскопия
- •Положение и интенсивность полос поглощения различных типов электронных переходов в уф-спектрах
- •Интенсивность электронных переходов
- •Эмпирические правила вычисления максимумов π π*-полос поглощения в сопряженных системах (правила физера-вудворда)
- •Инфракрасная спектроскопия
- •Ик спектры основных классов органических соединений
- •Функционально замещенные органические соединения
- •Ямр спектроскопия
- •Химический сдвиг
- •Электронное влияние индуктивного и мезомерного эффектов заместителей на величину химического сдвига.
- •Описание спектра
Количественный элементный анализ
Углерод и водород. Исходя из количества вещества, требующегося для элементного анализа, различают:
|
Необходимое количество пробы, г |
Макрометод |
0,2-0,3 |
Полумикрометод |
0,02-0,03 |
Микрометод |
0,002-0,005 |
Принцип количественного определения углерода и водорода был разработан еще Либихом (1831 г.). Точно взвешенное количество анализируемого вещества окисляют, сжигая в токе воздуха или кислорода в присутствии оксида меди (II), после чего взвешиванием (по разности весов) определяют количество поглощенного натронной известью диоксида углерода и количество абсорбированной хлористым кальцием воды. Наличие в составе анализируемого соединения других элементов приводит к образованию в процессе сжигания дополнительных газообразных продуктов, что, в свою очередь, вносит ошибку в получаемые результаты. В таком случае в трубку для сжигания необходимо вводить различные специальные вещества, которые поглощают мешающие анализу газообразные соединения. На рисунке схематически показаны два универсальных способа наполнения трубки для сжигания, пригодные для количественного анализа соединений любого элементного состава:
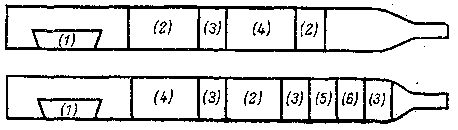
(1) – проба вещества; (2) – хромат свинца/оксид меди; 3) – серебро; 4) – диоксид свинца на асбесте; (5) – медь; (6) – оксид меди.
На следующем рисунке дана схема прибора для количественного элементного анализа органических соединений:
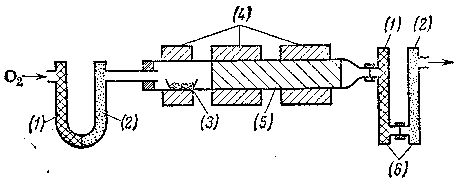
(1) – хлорид кальция; (2) – натронная известь (смесь NaOH + Ca(OH)2гашеная известь); (3) – проба вещества; (4) – печь; (5) – универсальные наполнители; (6) – поглотительные трубки.
Азот. Для определения количества азота, содержащегося в веществе, пробу нагревают в токе диоксида углерода в трубке в присутствии оксида меди (II) и металлической меди (для восстановления образующихся оксидов азота). После этого измеряют объем образующегося в этих процессах азота с учетом атмосферного давления, давления паров воды и температуры (метод Дюма).
Другим методом количественного определения азота является метод Кьельдаля. При этом вещество подвергают разложению нагреванием с концентрированной серной кислотой в присутствии ртуть- или селеносодержащего катализатора: при этом происходит восстановление до аммиака. После добавления едкого кали и перегонки ацидиметрически определяют количество образовавшегося аммиака в дистилляте. Метод Кьельдаля с успехом применяется для количественного определения азота в аминокислотах и аминах, однако он неприменим для анализа нитро- и азосоединений.
Галогены и сера. Количественное определение галогенов осуществляют гравиметрически в виде галогенидов серебра. Для этого вещества нагревают в металлической закрытой трубке (бомбе) с концентрированной азотной кислотой при температуре от 250 до 300C (метод Kaриуса). Содержащаяся в соединении сера при этом окисляется до сульфата, который также может быть легко определен гравиметрически в виде сульфата бария.
Для примера приведем расчет элементного анализа этанола.
После сжигания 0,0382 г вещества увеличение массы трубки с NaOH составил 0,0729 г, а трубки с хлоридом кальция 0,0448 г. Приросты массы соответствуют количеству образовавшихся при сжигании диоксида углерода и воды. Долю углерода х находим из пропорции:
CO2 : C=43,9988 : 12,0000=0,0729 : X
X = 0,0199
По отношению к массе взятой навески это составляет 52,05% углерода. Аналогичным образом, исходя из массы воды, находим содержание в пробе водорода – 0,0050 г или 13,09%. Сумма этих величин составляет 65,14%. Оставшиеся 34,86% принадлежат кислороду. Обычно содержание кислорода определяется именно таким косвенным образом. Прямой метод определения кислорода по методу Унтерцаухера предусматривает перевод кислорода в оксид углерода, окисляемого далее до диоксида углерода с помощью дийодпентоксида.
На основании найденного процентного содержания углерода, водорода и кислорода рассчитывают соотношения атомов этих трех элементов. Для этого величины в процентах делят на атомную массу и получают:


Нормируя относительно кислорода (разделив на меньшее число 2,18), получаем:
C : H : O = 2 : 6 : 1
Таким образом, брутто-формула этанола C2H6O
Развитие приборной техники позволило в самые последние годы разработать прибор для автоматического элементного анализа.
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ
На примере анализа этанола видно, что данные количественного элементного анализа дают возможность определить только простейшую формулу, указывающую соотношение атомов в молекуле. Для определения же истинной брутто-формулы необходимо знать молекулярную массу, последнюю можно определить на основании данных понижения температуры замерзания (криоскопия), повышения температуры кипения (эбуллиоскопия) или рассчитать по изменению осмотического давления (осмометрия). Наконец, молекулярную массу легко определить с помощью масс-спектрометрии. Молекулярную массу высокомолекулярных соединений получают, измеряя скорость диффузии или скорости седиментации в ультрацентрифуге или же путем измерения вязкости их растворов.
Криоскопический и эбулиоскопический методы определения молекулярной массы основываются на том, что давление пара раствора вещества всегда меньше, чем давление пара чистого растворителя (закон Рауля). Вследствие этого температура замерзания раствора всегда ниже, а температура его кипения всегда выше соответствующих констант чистого растворителя. Зная величину понижения температуры замерзания или повышения температуры кипения раствора какого-либо вещества, можно рассчитать его молекулярную массу по уравнению:
 ,
,
где M – молекулярная масса в гмоль-1; а – масса растворенного вещества в г; b – масса растворителя в г; t – наблюдаемое понижение температуры замерзания или повышения температуры кипения в C; tмоль – мольное понижение т. пл. или повышение т. кип. в Cкгмоль-1.
Измерение понижения температуры замерзания обычно проводят в приборе, предложенном Бекманом (метод Бекмана). В качестве растворителя могут быть использованы и твердые вещества, такие как камфора или нафталин. В таком случае на основании понижения температуры их плавления по приведенной выше формуле можно также рассчитать величину молекулярной массы (метод Раста).
ОПРЕДЕЛЕНИЕ СТРУКТУРЫ
Под структурой в химии понимают расположение частиц. Исходной точкой для определения структуры органического соединения является его брутто-формула. Следующий и важнейший шаг состоит в определении строения. Строение можно считать установленным, если определены вид и число атомов в молекуле, а также соединяющих их химических связей. Заключительной стадией определения структуры молекулы является установление ее пространственного строения (конфигурации и конформации).
ХИМИЧЕСКОЕ ДОКАЗАТЕЛЬСТВО СТРОЕНИЯ
До развития приборной базы строение соединения доказывали исключительно химическим путем (стоит отметить что в настоящее время эти методы так же не утратили ценности). Сведения о наличии функциональных групп получают на основании определенных качественных реакций.
Так, алкены и циклоалкены обесцвечивают растворы брома и перманганата. Альдегиды обладают восстановительными свойствами. Фенолы и енолы с растворами хлорида железа (III) дают характерное окрашивание от красного до голубовато-фиолетового. Некоторые кетоны (например, ацетон) или спирты (например, этанол) при обработке их гипойодидом натрия (NaOI) образуют йодоформ. Известно множество других подобных качественных реакций.
Если в соединении имеются реакционоспособные функциональные группы, то можно получать производные. Так, кетоны и альдегиды с 2,4-динитрофенилгидразином образуют хорошо кристаллизующиеся 2,4-динитрофенилгидразоны, с семикарбазидом – семикарбазоны, с гидроксиламином – оксимы. Спирты и фенолы реагируют с бензоилхлори-дом, образуя эфиры бензойной кислоты. Карбоновые кислоты после превращения их в ацилхлориды и обработки последних аминами дают амиды. Сравнением температур плавления двух или трех различных производных анализируемого соединения с литературными данными можно надежно идентифицировать соединение.
Обнаружение функциональных групп в молекуле ранее неизвестного соединения также не представляет в настоящее время принципиальных трудностей. Значительно сложнее, однако, получить информацию о строении углеродного скелета. Для этого следует провести химическую деструкцию соединения и идентифицировать образующиеся осколки.
Так, озонирование и последующее разложение образующихся озонидов позволяет определить положение кратной связи у большого числа; алкенов. В качестве других примеров подобного рода следует упомянуть химическую деградацию альдоз или деструкцию алкалоидов.
Однако химические методы зачастую требуют много времени и на их осуществление необходимы относительно большие количества вещества. В связи с интенсивным развитием приборной техники за последние 20 лет получил широкое распространение целый ряд спектральных методов определения строения органических соединений, такие как инфракрасная спектроскопия (ИК), раман-спектроскопия, электронная спектроскопия (УФ- и видимой области), спектроскопия ядерного магнитного резонанса (ЯМР), спектроскопия электронного парамагнитного резонанса (ЭПР), масс-спектрометрия (MC), рентгенография, электронография и т.д. Эти методы часто в значительно более короткие сроки позволяют получить информацию о структуре и пространственном строении молекулы.
