
- •Характеристика чистых веществ
- •Тонкослойная хроматография
- •Количественный элементный анализ
- •Физико-химические методы
- •Уф спектроскопия
- •Положение и интенсивность полос поглощения различных типов электронных переходов в уф-спектрах
- •Интенсивность электронных переходов
- •Эмпирические правила вычисления максимумов π π*-полос поглощения в сопряженных системах (правила физера-вудворда)
- •Инфракрасная спектроскопия
- •Ик спектры основных классов органических соединений
- •Функционально замещенные органические соединения
- •Ямр спектроскопия
- •Химический сдвиг
- •Электронное влияние индуктивного и мезомерного эффектов заместителей на величину химического сдвига.
- •Описание спектра
КУРС ЛЕКЦИЙ
МЕТОДЫ ИДЕНТИФИКАЦИИ И УСТАНОВЛЕНИЕ СТРОЕНИЯ БАС
ЛИТЕРАТУРА
1. Гордон, Форд. Спутник химика
2. Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965
3. Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК- и ЯМР-спектроскопии в органической химии. М.: Высшая школа, 1971.
4. Пентин Ю.А., Вилков Л.В. Физические методы исследования в химии: Учебник. М.: Мир, 2003 (спектроскопия ЯМР).
5. http://rushim.ru/books/spectroscopia/spectroscopia.htm
Одна из наиболее общих и важных задач органической химии – установление структурной формулы соединения, синтезированного или выделенного из природного сырья.
Любое соединение можно отнести к одной из двух групп: описанное ранее соединение, которое необходимо идентифицировать, либо новое соединение, строение которого необходимо установить.
Если соединение было прежде описано и его строение уже определено, то в химической литературе можно найти описание его свойств наряду с данными, на основании которых установлено его строение. В этом случае необходимо только показать, что данное соединение идентично описанному ранее соединению. Если же соединение прежде не описано, то необходимо провести тщательное доказательство его строения.
Первоначально очищают соединение и определяют его физические свойства: температуры плавления и кипения, плотность, показатель преломления и растворимость в различных растворителях.
Для того чтобы определить, какие элементы входят в состав соединения, проводят качественный элементный анализ. Затем определяют количественный состав и молекулярный вес и по полученным данным рассчитывают молекулярную формулу; это необходимо делать, если получено новое соединение.
Далее проводят систематическое изучение реакций соединения с определенными реагентами. Реакции вместе с элементным анализом, растворимостью и спектрами обычно позволяют охарактеризовать соединение, т.е. решить вопрос, к какому классу оно принадлежит.
Если окажется, что имеется соединение, физические свойства которого идентичны свойствам исследуемого неизвестного вещества, то можно считать, что эти соединения идентичны. Для подтверждения неизвестное соединение обычно превращают химической реакцией в новое соединение, называемое производным, и показывают, что это производное идентично с веществом, полученным таким же путем из ранее описанного соединения.
Если же в литературе не описано соединения, свойства которого были бы идентичны свойствам исследуемого неизвестного вещества, то необходимо установить его строение. Для этого проводят расщепление: разрушают молекулу, идентифицируют фрагменты и делают вывод об исходной структуре. Чтобы подтвердить любое доказательство строения, синтезируют исследуемое вещество методом, который не вызывает сомнений в строении полученного соединения.
Схематично план по расшифровке структуры органических соединений можно представить следующей блок-схемой:
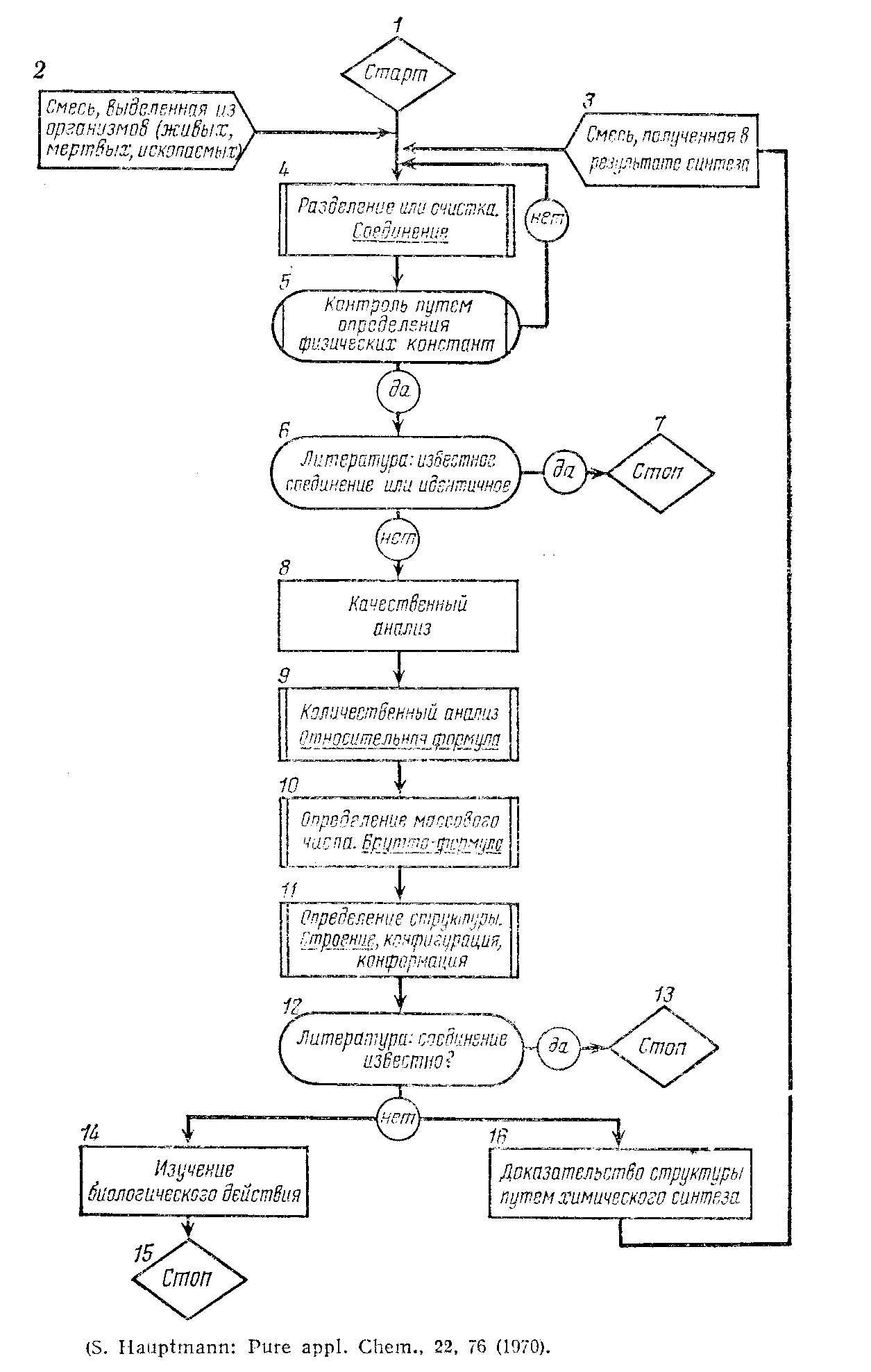
Характеристика чистых веществ
Чистое вещество характеризуется его физическими константами, такими как температура плавления или разложения, температура кипения, плотность, показатель преломления и молекулярная рефракция, удельное вращение, величина Rf (время удерживания для ГЖХ и ВЖХ). Эти величины не должны изменяться при повторной очистке; поэтому их называют константами вещества. Сравнение с константами известных веществ позволяет идентифицировать органические соединения.
Температура плавления (т. пл.) является важнейшей константой, характеризующей твердое вещество. Чистое индивидуальное твердое вещество всегда имеет четкую температуру плавления. Даже небольшие примеси посторонних соединений заметно понижают температуру плавления. Два соединения, имеющие одинаковые температуры плавления, идентичны, если их смесь плавится при той же температуре (проба смешанного плавления). Если же соединения не идентичны, то их смесь плавится ниже температур плавления индивидуальных компонентов: в этом случае говорят о депрессии температуры плавления. Температуру плавления определяют в приборе ПТП. Целый ряд органических соединений при плавлении разлагаются. В таком случае говорят о температуре разложения, которая в значительной мере зависит от скорости нагрева, причем при медленном нагревании она ниже, чем при быстром.
Температура кипения. В качестве характеристики жидких веществ используют их температуру кипения (т. кип.). Чистые вещества кипят при строго определенной температуре («в точке»), которая, однако, в противоположность температуре плавления, сильно зависит от давления. Поэтому при указании температуры кипения вещества всегда приводят давление, при котором она измерена. Если перегонка проводилась при нормальном давлении, то сведения о давлении обычно опускают. Температуру кипения определяют в процессе простой перегонки вещества; если же требуется особая точность определения, то используют эбуллиометр.
Плотность. Другой величиной, характеризующей жидкие вещества, является их плотность , представляющая собой массу единицы объема вещества. Для ее определения измеряют массу строго определенного объема вещества. Для этого жидкость помещают в специальный сосуд известного объема (пикнометр) и измеряют разницу весов заполненного и пустого пикнометра. Поскольку плотность меняется с изменением температуры, пикнометр перед взвешиванием термостатируют (чаще всего при 20C), причем температура, при которой проводились измерения, указывается вместе с величиной плотности (20).
Показатель
преломления. Третьей
константой, характеризующей жидкое
вещество, является показатель преломления
п. Согласно
закону Снеллиуса,
он соответствует углу полного внутреннего
отражения. Его определяют с помощью
рефрактометра. Поскольку показатель
преломления зависит от температуры
(чаще всего измеряют при 20C)
и длины волны света (обычно D-линия
натрия, 598,3 нм), то эти параметры обязательно
указываются вместе с величиной показателя
преломления ( ).
).
Мольная рефракция. Комбинация показателя преломления с такой константой, так же зависящей от температуры, как плотность, позволяет исключить влияние температуры. Такой специфической для каждого вещества величиной является мольная рефракция Mr, определяемая, согласно уравнению Лоренц – Лоренца, следующим выражением:

где M – мольная масса в гмоль-1; п – показатель преломления; – плотность в гсм -3.
Таким образом, мольная рефракция имеет размерность см3моль-1. Мольная рефракция какого-либо соединения аддитивно (лат. Additio – прибавление) складывается из атомных рефракций входящих в состав соединения элементов, а также величин, характеризующих типы связей (инкриментов).
Для характеристики
оптически активных соединений используют
показатель удельное вращение ( ).
).
Другой характеристикой чистого вещества служит время удерживания Rf при хроматографировании (ТСХ, ГЖХ, ВЖХ).
