
Водородная шкала потенциалов.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым — стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева — водородный электрод, справа — измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид
![]()
а схема элемента для измерения потенциала медного электрода
![]()
ЭДС элемента равна разности потенциалов правого и левого электродов:
![]()
А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу правого электрода. Таким образом, электродный потенциал по водородной шкале Е — это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева — стандартный водородный электрод.
Обычно индексы «п» и «л» при обозначении потенциалов опускаются, и потенциалы записываются через «фи» с индексами исходных веществ и продуктов реакции.
По отношению к системе Н2/2Н+ некоторые вещества будут вести себя как окислители, другие — как восстановители. В настоящее время получены стандартные потенциалы практически всех металлов и многих неметаллов, которые характеризуют относительную способность восстановителей или окислителей к отдаче или захвату электронов.
Потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-“, а знаком “+” отмечены потенциалы электродов, являющихся окислителями.
Если расположить металлы в порядке возрастания их стандартных электродных потенциалов, то образуется так называемый электрохимический ряд напряжений металлов:
Li, Rb, К, Ва, Sr, Са, Nа, Мg, Аl, Мn, Zn, Сr, Fе, Сd, Со, Ni, Sn, Рb, Н, Sb, Вi, Сu, Hg, Аg, Рd, Рt, Аu.
Ряд напряжений характеризует химические свойства металлов.
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в ряду напряжений металлов после него. Исключениями являются лишь щелочные и щелочноземельные металлы, которые не будут восстанавливать ионы других металлов из растворов их солей. Это связано с тем, что в этих случаях с большей скоростью протекают реакции взаимодействия металлов с водой.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах, поскольку потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Именно поэтому электрохимический ряд начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция?
Так, все полуреакции окисления галогенид-ионов до свободных галогенов
2Cl-- 2e = Сl2 Е0= -1,36 В (1)
2Br--2е = Вr2 E0 = -1,07 В (2)
2I--2е = I2 E0 = -0,54 В (3)
могут быть реализованы в стандартных условиях при использовании в качестве окислителя оксида свинца (IV) (Е0 = 1,46 В) или перманганата калия (Е0 = 1,52 В). При использовании дихромата калия (E0 = 1,35 В) удается осуществить только реакции (2) и (3). Наконец, использование в качестве окислителя азотной кислоты (E0 = 0,96 В) позволяет осуществить только полуреакцию с участием иодид-ионов (3).
Таким образом, количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
40. Уравнение Нернста и его физический смысл. Расчет электродных потенциалов в условиях отличных от стандартных.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов.

E — электродный потенциал, E0 — стандартный электродный потенциал (В)
R — универсальная газовая постоянная (8.31 Дж/(моль·K))
T — абсолютная температурав К
F — постоянная Фарадея (96500 Кл/моль)
n — число молей электронов, участвующих в процессе
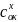 и
и  — конц-я соответственно окисленной
и восстановленной форм вещества
— конц-я соответственно окисленной
и восстановленной форм вещества
Xи Y– стехиометрические коэф-ты в уравнении электродного процесса
Потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста. Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
41. Redox (окислительно-восстановительные) потенциалы и определение направления самопроизвольного протекания ОВР.
Количественной характеристикой окислительно-восстановит. вещ-в, находящихся в растворах или соприкасающихся с ними, являются окислительно-восстановительные/электродные потенциалы.
Величина ОВП зависит от:
- природы вещ-в, участвующих в электродном процессе Men++ne↔Me
- соотношения конц-й окисленной и восстановленной форм этих вещ-в
- от tо
- от природы растворителя
- pH среды
Эта зависимость описывается уравнением Нернста:


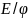 –
электродный потенциал
при данных усл-х
–
электродный потенциал
при данных усл-х
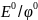 –
стандартный потенциал,
измеренный при Т=298К (25гр.), при давлении
для газообразных вещ-в 101,3кПа и конц-ии
1моль/л
–
стандартный потенциал,
измеренный при Т=298К (25гр.), при давлении
для газообразных вещ-в 101,3кПа и конц-ии
1моль/л
 –
ур-еНернста для
металлич. электрода
–
ур-еНернста для
металлич. электрода
Обычно пользуются относит-ми значениями ОВП, т.к. абсолютныезнач-я определить невозможно.
Пользуясь табл.стандартных электродных потенциалов, можно опред. направление любой ОВР, протекающей в растворе. Окислительная способность проявл. в большей степени у того вещ-ва, которое в роли окислителя при одинак. усл-ях имеет более высокое знач-е электродного потенциала. Восстановительная способность вещ-ва тем выше, чем меньше значение стандартного электродного потенциала.
Для самопроизвольно протекающих реакций окисления-восстановления выполняется критерий ΔG°298 << 0 и, следовательно, (ϕ°Ок - ϕ°Вос) >>0. Такие реакции идут в прямом направлении; степень их протекания тем выше, чем больше разность (ϕ°Ок - ϕ°Вос).При ΔG°298 >> 0 и, следовательно, (ϕ°Ок - ϕ°Вос) « 0 реакции в прямом направлении протекать не будут, но термодинамически возможными становятся обратные реакции. Например, реакция (Mn2+ - восстановитель, I2 - окислитель)
42 Электрохимические процессы. Гальванические элементы (ГЗ). Концентрационные ГЭ. ЭДС и ее вычисление. Связь энергии Гиббса с ЭДС гальванических элементов.
Электрохимические процессы.
Электрохимические процессы это окислительно-восстановительные реакции, которые сопровождаются возникновением электрического тока или вызываются электрическим током.
В электрохимических процессах окислительная и восстановительная полуреакции пространственно разделены, а электроны переходят от восстановителя к окислителю не непосредственно, а по проводнику внешней цепи, создавая электрический ток. В О.В.Р этого типа наблюдается взаимное превращение химической и электрической форм энергии.
Выделяют две группы электрохимических процессов:
· процессы превращения электрической энергии в химическую (электролиз);
· процессы превращения химической энергии в электрическую (гальванические элементы).
Простейшая электрохимическая система состоит из двух электродов – проводников первого рода с электронной проводимостью, находящихся в контакте с жидким (раствор, расплав) или твердым электролитом - ионным проводником второго рода. Электроды замыкаются металлическим проводником, образующим внешнюю цепь электрохимической системы.
Гальванические элементы или химические источники электрической энергии это устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую.
Гальванический элемент - это устройство, состоящее из двух или более электродов, соединенных между собой.
ХИЭЭ – химический источник электроэнергии (гальванический элемент).
В гальваническом элементе все время происходит нарушение равновесия данной реакции.
![]()
Гальванический элемент Якоби - Даниэля состоит из двух металлов с различными электродными потенциалами, например, меди и цинка. Электроды соединены между собой двояко. Металлические электроды соединены между собой металлическим проводником, а солевые растворы соединены либо полупроницаемой мембраной, либо электролитическим ключом
Электролитический ключ проводит анионы. Таким образом, в гальваническом элементе двоякая проводимость: электронная и ионная. Анодом является активный металл, катодом – пассивный.
Рис.4
Эти электроды отличаются друг от друга только концентрациями солевых растворов.
Недостатки концентрационных гальванических элементов:
разрушаемый анод,
малая ЭДС.
Концентрационные элементы используются в тех случаях, где необходима малая ЭДС.
Гальванический элемент, составленный из одинаковых металлов, контактирующих с растворами солей этих же металлов различной концентрации (активности), называется концентрационным.
Схематически концентрационный элемент можно описать следующим образом
 .
.
Электрический ток возникает при замыкании внешней цепи в процессе переноса вещества от анода к катоду и выравнивании концентраций. Оба электрода при работе не испытывают изменения.
Потенциалы электродов описываются уравнениями:
![]() ,
,
![]() ,
,
а э.д.с. концентрационного гальванического элемента выражением
 .
.
Eэ = - [ΔG/(n·F)].
Это уравнение показывает связь между химической и электрической энергиями. Зная энергию Гиббса реакции, можно определить э.д.с. гальванического элемента и наоборот.
Энергия Гиббса реакции зависит от активностей реагентов и продуктов реакции или парциальных давлений. Рассчитаем э.д.с. для реакции
![]() .
.
Энергия Гиббса по уравнению Вант-Гоффа равна
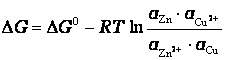 .
.
Здесь ΔG0
– стандартная энергия Гиббса реакции;
![]() - активности реагентов и продуктов
реакции, соответственно, (для газов
необходимо использовать вместо
активностей парциальные давления p).
- активности реагентов и продуктов
реакции, соответственно, (для газов
необходимо использовать вместо
активностей парциальные давления p).
Так как ΔG = - n·F·Eэ, то
 .
.
Отсюда
 ,
,
где учтено, что активности чистых металлов aCu = aZn = 1, n = 2.
![]() - стандартная э.д.с.
элемента.
- стандартная э.д.с.
элемента.
Стандартной э.д.с. элемента называется э.д.с., если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакции равны единице.
Для рассматриваемой реакции стандартная энергия Гиббса ΔG0 = - 212,3 кДж/моль. Поэтому стандартная э.д.с. элемента Даниэля-Якоби при температуре 298 К
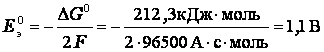
43. Электролиз. Катодные и анодные процессы в расплавах и водных растворах электролитов. Электролиз с растворимым анодом. Законы Фарадея. Практическое применение электролиза.
Электролиз – это несамопроизвольный, суммарный электрохимический процесс, охватывающий раздельное, но одновременно протекающее на электродах электролизера окисление и восстановление ионов, атомов, молекул раствора за счет электрического тока, возбуждаемого внешней электродвижущей силой.
Электролиз расплавов. При электролизе расплава электролита на электроде, подключенном к минусу источника тока (катоде), через который в систему поставляются электроны, восстанавливаются катионы электролита в атомы. На другом электроде, присоединенном к плюсу источника тока (аноде), с помощью которого из системы отводятся электроны, окисляются анионы электролита. Например, при электролизе хлорида натрия ионы натрия восстанавливаются в атомы по уравнению
Na+ + е ?Na0,
а на аноде происходит окисление ионов хлора в молекулы:
2Cl- -2e ?Cl2.
Электролиз является процессом, в ходе которого происходит превращение электрической энергии в химическую.
