
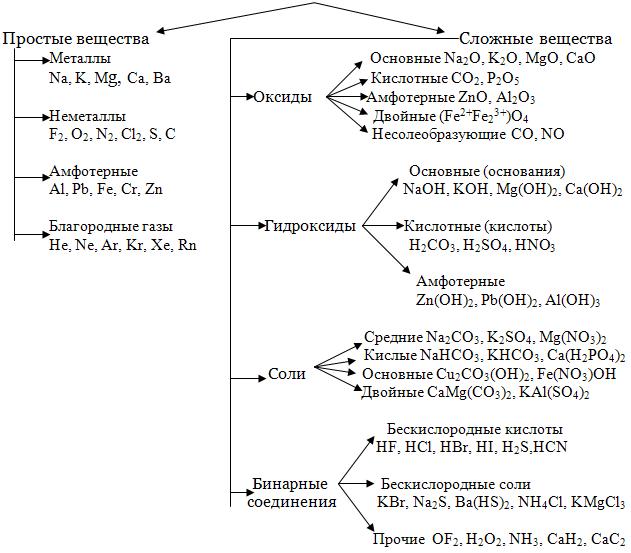
Важнейшие классы неорганических соединений. Кислотно–основные свойства оксидов и гидроксидов. Классификация и номенклатура солей.
К
важнейшим классам неорганических
веществ по традиции относят
Кислотно-основные свойства оксидов определяют по их отношению к кислотам и
основаниям. Если оксид реагирует с кислотой, то ему присущи основные свойства, если с
основанием - кислотные. Если же оксид может реагировать и с кислотой, и с основанием,
то такой оксид является амфотерным. Кислотно-основной характер оксидов и соответствующих им гидроксидов совпадает. Так, Mg(OH)2 - основной гидроксид, MgO - основной оксид; Zn(OН)2 - амфотерный гидроксид, a ZnO - амфотерный оксид; Н2SО4 - кислотный гидроксид, a SО3 - кислотный оксид и т.д.
Кислотно-основные свойства гидроксидов зависят от того, какая из двух связей в
цепочке Э-О-Н является менее прочной. Если менее прочна связь Э-О, то гидроксид
проявляет основные свойства, если О-Н - кислотные. Чем менее прочны эти связи, тем
больше сила соответствующего основания или кислоты. Количественной мерой силы
кислоты и основания является величина константы их электролитической диссоциации. У
амфотерных гидроксидов связи Э-О и О-Н сопоставимы по прочности, поэтому такие
соединения проявляют свойства как кислоты, так и основания.
Номенклатура солей.
Если одна степень окисления то окончание –АТ
Если низшая степень окисления то приставка ГИПО- и окончание –АТ
Если самая высокая степень то приставка ПЕР- и окончание –АТ
КИСЛАЯ СОЛЬ: то же самое + приставка ГИДРО-
ОСНОВНЫЕ СОЛИ: то же самое + гидроксид
Квантовая механика и состояние электрона в атоме. Квантовые числа : n , l , m и ms . Атомные орбитали.
Квантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов), а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.
Состояние электрона в атоме
Электрон является
элементарной частицей, поведение которой
подчиняется законам квантовой механики.
В основе квантовой механики лежат
постулат о КОРПУСКУЛЯРНО-ВОЛНОВОМ
ДУАЛИЗМЕ – проявлении микрообъектом
как корпускулярных свойств (способности
проявлять свое действие как целой
частицы), так и свойств волны, длина
которой
![]() задается
формулой да Бройля:
задается
формулой да Бройля:
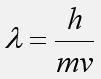
где h – постоянная Планка, m – масса частицы, v – её скорость.
Состояние электрона
в атоме описывается волновой функцией
![]() ,
которая является функцией координат и
времени:
,
которая является функцией координат и
времени:
![]()
Квадрат волновой
функции представляет собой вероятность
нахождения электрона в момент времени
t в объеме (x+![]() x,
y+
y,
z+
z).
Волновая функция электрона в атоме
определяется из волнового уравнения
(уравнения Шредингера):
x,
y+
y,
z+
z).
Волновая функция электрона в атоме
определяется из волнового уравнения
(уравнения Шредингера):
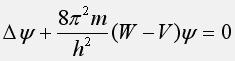
где
![]() –
оператор двойного дифференциирования
функции по координатам (“набла”), m –
масса электрона, h – постоянная Планка,
W – полная энергия электрона, V – его
потенциальная энергия в потенциальном
поле ядра.
–
оператор двойного дифференциирования
функции по координатам (“набла”), m –
масса электрона, h – постоянная Планка,
W – полная энергия электрона, V – его
потенциальная энергия в потенциальном
поле ядра.
Состояние электрона в атоме, заданное набором квантовых n, l, ml чисел называется орбиталью.
n – главное квантовое число, определяет энергию орбитали. Чем больше n, тем выше энергия. n принимает значения чисел натурального ряда: n = 1, 2, 3…
l – орбитальное квантовое число, определяет форму орбитали. l принимает целочисленные значения от 0 до n—1 : l = 0, 1, 2…n—1. Очевидно, что для каждого значения n существует свой набор значений l. Каждому значению l соответствует определенная форма орбитали, которая имеет и буквенное обозначение:
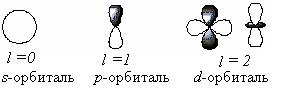
Значению l = 3 соответствует f-орбиталь, форма которой здесь не приведена.
ml - магнитное квантовое число, принимающее целочисленные значения от —l до +l: = -l…-2, -1, 0, +1, +2…+l, всего 2l+1 значение. Число значений, которое может принимать ml, соответствует числу орбиталей данной формы для заданного n. Например, для l = 0 (s-орбиталь) mlпринимает единственное значение ml = 0, т.е. s-орбиталь одна, для l = 1 – три значения ml : -1, 0. +1, т.е. р-орбиталей – три, l = 2 – пять значений ml : -2, -1, 0, +1, +2, d-орбиталей пять и т.д.
Кроме трех квантовых
чисел, получающихся из волнового
уравнения, электрон обладает спиновым
квантовым числом mS,
которое характеризует собственное
неорбитальное внутреннее движение
электрона и принимает значения mS
= ±1/2 (в единицах h/2![]() ).
Таким образом, состояние электрона в
атоме может быть задано набором четырех
квантовых чисел: n,
l,
ml
, mS.
).
Таким образом, состояние электрона в
атоме может быть задано набором четырех
квантовых чисел: n,
l,
ml
, mS.
3. Строение многоэлектронных атомов. Электронные формулы атомов химических элементов. Правила и порядок заполнения атомных орбиталей (правила Клечковского, Гунда ,принцип Паули)
Принцип Паули: в атоме не может быть 2 е с одинаковым значением 4х квантовых чисел. Этот набор значений полностью определяет энергетическое состояние электрона. 2 е, находящихся на одной АО называются спаренными. Общее число орбиталей на эн. уроне со зн. n = n*2. Следовательно, max электронная емкость = 2n*2.
Правило Клечковского- эмпирическое правило, описывающее энергетическое распределение орбиталейв многоэлектронных атомах.
Заполнение электронами орбиталей в атоме происходит с нижнего энергетического уровня к верхнему.
ПравилоГунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненныхорбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
4. Периодический закон и периодическая система элементов Д.И. Менделеева (ПСЭ). Структура ПСЭ (периоды, группы, подгруппы), физический смысл порядкового номера элемента, номера периода и группы. Значение периодического закона.
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Точная формулировка:свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Порядковый номер элемента показывает заряд ядра, который определяется числом протонов в нём.
Номер периода показывает энергетический уровень, на котором располагаются электроны, в каком удалении от ядра, чем больше номер, тем большим запасом энергии должны обладать электроны.
Номер группы показывает число электронов на внешнем электронном слое для элементов главных подгрупп, и в целом максимальную валентную возможность элементов данной группы.
5.Периодическое изменение свойств химических элементов: эффективные радиусы атомов и ионов, потенциалы ионизации, сродство к электрону, электроотрицательность. Причина периодичности свойств.
Атомные радиусы, потенциал ионизации, сродство к электрону, электроотрицательность Химическая природа элемента обусловлена способностью его атома терять или приобретать электроны. Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону. Энергией ионизации ( Eи ) называется минимальное количество энергии, необходимое для отрыва и полного удаления электрона из атома в газовой фазе при T = 0 K без передачи освобожденному электрону кинетической энергии с превращением атома в положительно заряженный ион: Э + Eи = Э+ + e- Энергия ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов. Сродством к электрону ( Ee ) называется энергия, выделяемая или поглощаемая при присоединении электрона атому в газовой фазе при T = 0 K с превращением атома в отрицательно заряженный ион без передачи частице кинетической энергии: Э + e- = Э- + Ee. Максимальным сродством к электрону обладают галогены, особенно фтор (Ee = -328 кДж/моль). Величины Eи и Ee выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ). Способность связанного атома смещать к себе электроны химических связей, повышая около себя электронную плотность называется электроотрицательностью. шкала электроотрицательностей, предложенная Л.Полингом, В этой шкале электроотрицательность выражается в относительных величинах. От фтора к водороду электроотрицательность возрастает. В периодах наблюдается общая тенденция роста энергии ионизации и электроотрицательности с ростом заряда ядра атома, в группах эти величины с увеличением порядкового номера элемента убывают. Следует подчеркнуть, что элементу нельзя приписать постоянное значение электроотрицательности, так как оно зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое он входит, числа и вида атомов-соседей. Атомные и ионные радиусы. Размеры атомов и ионов определяются размерами электронной оболочки. Согласно квантово-механическим представления электронная оболочка не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных.
Зависимость атомных и ионных радиусов от заряда ядра атома элемента и носит периодический характер. В периодах по мере увеличения атомного номера радиусы имеют тенденцию к уменьшению. Наибольшее уменьшение характерно для элементов малых периодов, поскольку у них заполняется внешний электронный уровень. В больших периодах в семействах d- и f- элементов это изменение менее резкое, так как у них заполнение электронов происходит в предпредвнешнем слое. В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
6.Химическая связь (ХС). Природа и условия образования ХС. Основные характеристики ХС: энергия связи, длина связи, валентный угол. Основные виды ХС: ковалентная, ионная, металлическая.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Основные характеристики химической связи — прочность, длина, полярность.
Причина образования химических связей – выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами. Более точно химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков, и уменьшением полной энергии системы.
Основные характеристики химической связи:
Энергия связи (ЕСВ ) – минимальная энергия, необходимая для разрушения связи.
Длина связи (LСВ )– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее.
Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – ненасыщаема.
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то ненаправлена.
Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи.
Угол между воображаемыми линиями, которые можно провести через центры связанных атомов называется валентным.
Ковалентная связь
Ковалентная связь – связь между атомами за счет общих электронных пар.
При сближении двух атомов водорода возможно два случая:
1. по мере сближения силы отталкивания между атомами неограниченно возрастают (кривая 1), при этом энергия системы увеличивается и система не может быть устойчивой.
2. силы отталкивания сменяются силами притяжения, которые достигают максимума при расстоянии между ядрами, равном ro (кривая 2), энергия системы в этом состоянии минимальная и меньше суммарной энергии исходных атомов.
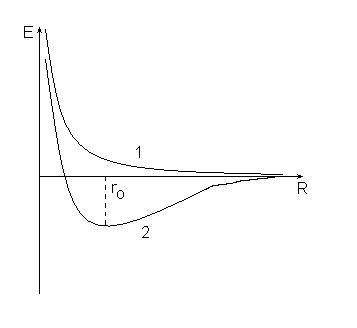
Такое отличие в поведении атомов вызвано разными значениями спинового квантового числа для электронов в исходных атомах. Если спины электронов были одинаковыми, то это кривая 1, если разными – то 2:
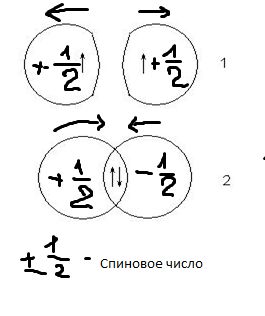
Состояние, которое при этом возникает, соответствует устойчивой системе, в которой между ядрами атомов существует область с повышенной электронной плотностью. Эта область компенсирует взаимное отталкивание ядер и называется областью перекрывания орбиталей или общей электронной парой.
Ковалентная связь образуется по двум механизмам – обменному, когда каждый из участвующих в образовании связи атомов предоставляет для общей электронной пары по одному электрону (А) и донорно-акцепторный, когда донор дает электронную пару, а акцептор – свободную орбиталь (В). На рисунке приведены схемы этих механизмов и соотвествующие им реально протекающие реакции:
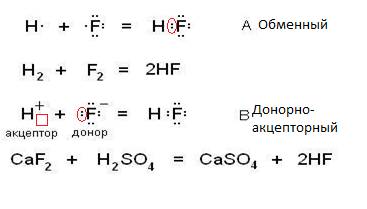
Образующиеся в результате молекулы ничем друг от друга не отличаются.
Полярная и неполярная ковалентная связь
По симметрии распределения заряда ковалентные связи делятся на полярные и неполярные.
Если общая электронная пара (область перекрывания орбиталей) расположена симметрично относительно связанных ядер, связь называется ковалентной неполярной, если смещена в сторону одного из ядер – ковалентной полярной.
Ковалентная неполярная связь возникает между атомами одного и того же элемента, при этом из-за симметрии распределения зарядов связь не обладает дипольным моментом. Примеры молекул с неполярной ковалентной связью: H2, O2, F2,Cl2, N2, Ag2 .
Если участвующие в образовании связи атомы отличаются по электроотрицательности, то возникает ковалентная полярная связь. Общая электронная пара смещена в сторону атома с большей электроотрицательностью, возникающая в результате асимметрия в распределении зарядов приводит к появлению у связи дипольного момента.Часто смещение электронной пары показывают стрелкой, например:
![]()
Символом
![]() обозначены
дипольные заряды, которые могут быть
меньше заряда электрона, но существуют
только совместно.
обозначены
дипольные заряды, которые могут быть
меньше заряда электрона, но существуют
только совместно.
![]() -
и
-связи
-
и
-связи
-(сигма) и -связи различают по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов проходит через область перекрывания орбиталей, связь называется -связью, если область перекрывания лежит в стороне от этой линии - -связью.
-связи образуются при перекрывании s-s орбиталей атомов (А), р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей:
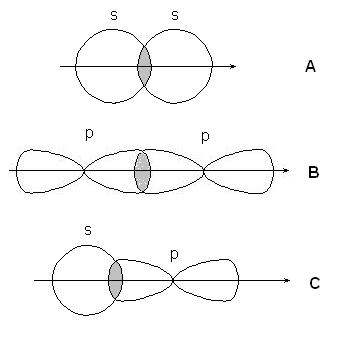
-связи - при перекрывании р-р орбиталей:
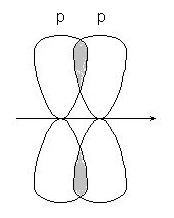
-связь менее прочна, чем -связь, ее электроны легче подвержены внешнему воздействию.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Механизм металлической связи
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, происходящие из атомов металлов от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Ионная связь — (очень сильно полярная связь) очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел.
Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
![]()
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.).
7. Ковалентная связь. Метод валентных связей. Свойства ковалентной связи: насыщаемость, поляризуемость, направленность.
Ковалентная связь -Химическая связь, образованная путем обобществления пары электронов двух атомов.
Свойства ковалентной связи
Насыщаемость- способность атомов образовывать ограниченное число ковалентных связей. 2.
Направленность ковалентной связи определяет пространственную структуру молекул. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах.
Если общая электронная пара (область перекрывания орбиталей) расположена симметрично относительно связанных ядер, связь называется ковалентной неполярной, если смещена в сторону одного из ядер – ковалентной полярной.
Ковалентная неполярная связь возникает между атомами одного и того же элемента, при этом из-за симметрии распределения зарядов связь не обладает дипольным моментом. Примеры молекул с неполярной ковалентной связью: H2, O2, F2,Cl2, N2, Ag2 .
Если участвующие в образовании связи атомы отличаются по электроотрицательности, то возникает ковалентная полярная связь. Общая электронная пара смещена в сторону атома с большей электроотрицательностью, возникающая в результате асимметрия в распределении зарядов приводит к появлению у связи дипольного момента.
Метод валентных связей
В основе метода ВС лежат следующие положения:
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Электроны, находящиеся во внешнем электронном слое, обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы водорода можно представить следующим образом: Н• + •Н → Н:Н
Эта схема показывает, что при соединении двух атомов водорода в молекулу каждый из атомов приобретает устойчивую двухлектронную оболочку.
8. Представление о гибридизации атомных (валентных) орбиталей. Виды гибридизации: sp. sp2, sp3 и пространственная конфигурация молекул. Примеры.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Виды гибридизации
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
sp3-гибридизации
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Примеры |
sp |
2 |
Линейная |
|
sp2 |
3 |
Треугольная |
|
sp3 |
4 |
Тетраэдрическая |
|
dsp2 |
4 |
Плоскоквадратная |
Ni(CO)4, [PdCl4]2- |
sp3d |
5 |
Гексаэдрическая |
PCl5, AsF5 |
sp3d2 |
6 |
Октаэдрическая |
SF6, Fe(CN)63-, CoF63- |
9. Ионная связь. Свойства ионной связи . Поляризация ионов. Свойства веществ с ионной связью. Примеры.
Ионная связь — (очень сильно полярная связь) очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел.
Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.).
Примеры ионной связи NaI, MgBr2, AlCl3, CaCl2
10. Основные виды взаимодействия молекул : а) водородная связь ; б) межмолекулярное взаимодействие ( силы Ван-дер-Ваальса ).
Водородная связь
связь образует водородный атом, связанный с атомом углерода в соединениях типа НСХ3, где X — электроотрицательный атом или группа (например, в HCN, фторуглеводородах). Хотя в настоящее время природа водородной связи еще до конца не выяснена, однако определенное представление о ней уже можно составить.
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:
водородная связь по своему характеру является, по-видимому, электростатической; она образуется вследствие притяжения ковалентно связанного протона свободными электронами атома другой молекулы. При этом протон находится не посредине между связываемыми им атомами (даже если они одинаковы), а ближе к тому атому, с которым он связан ковалентно. Так, в случае воды

одно расстояние О—Н равно 0,99 А, а другое 1,76 А.
Вопрос о том, находится ли водород в фиксированном положении или он совершает колебания между двумя положениями равновесия, в общем случае еще неясен, хотя исследование хингидрона методом меченых атомов свидетельствует о фиксированном положенииводорода водородной связи в этом соединении.
Энергия водородной связи мала
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, например, ссероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде вызвана образованием водородных связей с молекулами воды..
Изучение водородных связей должно пролить дополнительный свет на строение и свойства многих органических веществ.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ
Сила Ван-дер-Ваальса,
сила межмолекулярного притяжения, имеет
три составляющие. Они обладают несколько
отличной физической природой, но их
потенциал зависит от расстояния между
молекулами одинаково – как ![]() .
Это счастливое обстоятельство позволяет
непосредственно сравнивать константы
взаимодействия, соответствующие трем
составляющим силы Ван-дер-Ваальса,
причем по причине их одинаковой
зависимости от расстояния, пропорция
между компонентами будет сохраняться
при различных
.
Это счастливое обстоятельство позволяет
непосредственно сравнивать константы
взаимодействия, соответствующие трем
составляющим силы Ван-дер-Ваальса,
причем по причине их одинаковой
зависимости от расстояния, пропорция
между компонентами будет сохраняться
при различных ![]() .
.
Выводы.
Сила Ван-дер-Ваальса, являющаяся электростатическим взаимодействием молекулярных оболочек, имеет три составляющие: ориентационное, индукционное и дисперсионное взаимодействия.
Несмотря на то, что три составляющие силы Ван-дер-Ваальса, имеют разное происхождение, их зависимость от расстояния имеет одинаковый характер – .
11. Агрегатное состояние вещества. Химическое строение твердого тела. Типы кристаллических решеток. Примеры.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов. При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов. Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела. В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях. В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью. По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические. Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации). Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие). Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний. В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д.
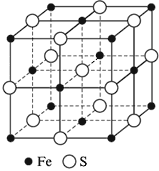
Ионные кристаллические решетки- состоят из ионов. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле.
Атомные кристаллические решетки-решетки, в узлах которых находятся отдельные атомы.Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами.
Металлическая кристаллическая решетка- имеет металлическую связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является металлическая.
Молекулярная кристаллическая решетка содержит в узлах молекулярных кристаллических решёток молекулы, которые связаны друг с другом слабыми межмолекулярными силами. Такие кристаллы образуют вещества с ковалентной связью в молекулах.

На рис. 2 приведены примеры простых кристаллических решеток: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемно-центрированная кубическая решетка; 4 – гексагональная решетка.
12. Элементы химической термодинамики. Термодинамические системы. Термодинамические характеристики. Функции состояния системы
Химическая термодинамика изучает изменения энергии в результате процессов в материальных системах, приводящих к изменению состава и свойств физических тел, из которых построена данная система.
Термодинамической системой называется комплекс взаимодействующих между собой физических тел, мысленно обособленный от окружающей среды.
Термодинамические системы бывают трех видов:
1. Изолированные (нет обмена ни веществом, ни энергией с окружающей средой).
2. Замкнутые (нет обмена веществом с окружающей средой).
3. Открытые (есть и энерго- и массообмен с окружающей средой).
Параметры состояния определяют функции состояния, тем или иным образом однозначно характеризующие энергию этого состояния. Однозначность проявляется в том, что функции состояния не зависят от истории системы, т.е. от того, как она попала в данное состояние.
внутренняя энергия является однозначной функцией состояния вещества (или совокупности вещества) и зависит только от параметров состояния, тогда как по отдельности каждая из величин, определяющих внутреннюю энергию (теплота Q, работа W) зависит от пути процесса, переводящего реагенты в продукты.
Другой функцией состояния системы является энтальпия – тепловой эффект реакции при постоянном давлении (dН).
13. Термохимия. Тепловые эффекты химических реакций. Тепловые эффекты в изобарных и изохорных процессах. Термохимические характеристики: внутренняя энергия и энтальпия.
Термохимия – это раздел химической термодинамики изучающий взаимные превращения химической и тепловой энергии. Всякая химическая реакция сопровождается определенным энергетическим эффектом( кол-во энергии, которое должно быть подведено к продуктам реакции или отведено от них, чтобы они имели такую же температуру, как исходные вещества. Если энергия выделяется во внешнюю среду, то такая реакция экзотермическая, а если поглощается, то эндотермическая.
I-ый закон термодинамики: тепло, подведенное к системе идет на совершение системой работы и изменение внутренней энергии.
Q = ΔE + A -запись закона сохранения энергии
Изобарный процесс (Р - const)
Qр = ΔE + A = ΔE + pΔV
(E2 – E1) – (V1 – V2) = (E2 + pV2) – (E1 + pV1) = Н2 – Н1 = ΔH
Q = ΔH
H – энтальпия (теплосодержание системы)
Q = H > 0 Тепловой эффект реакции положителен –
Тепло поглощается – эндотермический процесс
Q = H < 0 Тепловой эффект реакции отрицателен –
Тепло выделяется – экзотермический процесс
Изохорный процесс
Qv = ΔE + A = ΔE + pΔV = ΔE (ΔV = 0, ΔVp = 0)
Q = ΔE
ΔE – внутренний эффект реакции, протекающей при постоянном V.
Тепловой эффект реакции, протекающей при постоянном давлении, больше теплового эффекта реакции при постоянном объеме на величину работы расширения pΔV.
Внутренняя энергия вещества (или системы) — это полная энергия частиц, составляющих данное вещество. Она слагается из кинетической и потенциальной энергий частиц. Внутренняя энергия зависит от состояния вещества.
Внутренняя энергия зависит от природы, массы, от условий в которых находится.
Различие внутренних энергий исходных веществ и продуктов реакций и обусловили тепловые эффекты. При этом в случае изохорных процессов, поглощенная теплота расходится на изменение внутренней энергии системы. Но чаще всего в лабораториях и в промышленности химические процессы проходят не при постоянном объеме, а при постоянном давлении. При изобарных процессах тепловой эффект связан с изменением энтальпии системы.
![]()
Давление = const
Энтальпия
Это термодинамическая функция состояния системы, отвечающая тепловому эффекту реакции в этой системе при постоянном давлении. Энтальпия связана с внутренней энергией уравнения. Научное и практическое значение имеет не абсолютное значение энтальпии (H) , которое измерить невозможно, а лишь разность

т.е. изменение энтальпии в ходе реакции. Если реакция протекает с выделением теплоты(экзотермическая), то изменение энтальпии системы отрицательно. В противоположном случае(эндотермическая) положительная.
Уравнения реакции содержащие значения дельта Н называют термохимическими уравнениями.
14. Закон Гесса и следствия из него. Стандартная энтальпия образования веществ, единица измерения. Энтальпия химической реакции. Термохимические расчеты.
Закон Гесса утверждает: тепловой эффект реакции не зависит от промежуточных стадий, а определяется лишь начальными и конечными состояниями веществ, если единственной работой является работа расширения, и объем (или давление) в ходе реакции остается неизменным. Таким образом, если возможно проведение реакций несколькими способами, то при совпадении состояний реагентов и продуктов реакции тепловой эффект ее должен быть одним и тем же.
Первое следствие
закона Гесса.
Энтальпия химической реакции равна
сумме энтальпий образования продуктов
реакции за вычетом суммы энтальпий
образования исходных веществ.
Энтальпия
образования вещества это энтальпия
реакции образования 1 моль соединения
из простых веществ, устойчивых при
стандартных условиях.
Например. энтальпия образования нитрата
натрия равна энтальпии реакцииNa(кр)
+ ½N2(г)
+ 3/2О2(г)
=
NaNO3(кр), ![]() Энтальпия
образования простых веществ при
стандартных условиях принята равной
нулю. Энтальпия является свойством
вещества, также как и масса, объем и т.д.
Энтальпия _
функция состояния системы, т.е. ее
изменение не зависит от пути процесса,
а определяется только состоянием системы
в конце и начале процесса.
Энтальпия
образования простых веществ при
стандартных условиях принята равной
нулю. Энтальпия является свойством
вещества, также как и масса, объем и т.д.
Энтальпия _
функция состояния системы, т.е. ее
изменение не зависит от пути процесса,
а определяется только состоянием системы
в конце и начале процесса.
Энтальпия химической реакции в общем виде аА + bB = dD + eE (2.10)
определяется по
уравнению ![]()
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия сгорания
вещества В
![]() это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например
энтальпия реакции сгорания метанола
есть изменение энтальпии следующей
реакции: СН3ОН
+ 3/2О2
= СО2
+ 2Н2О
это
энтальпия реакции окисления кислородом
1 моль соединения до образования
высших оксидов. Например
энтальпия реакции сгорания метанола
есть изменение энтальпии следующей
реакции: СН3ОН
+ 3/2О2
= СО2
+ 2Н2О
Энтальпия химической реакции в общем виде (2.10) определяется по уравнению
![]()
Энтальпия образования (теплота образования), энтальпия реакции образования данного вещества (или раствора) из заданных исходных веществ. Энтальпией образования химических соединения называют энтальпию реакции образования данного соединения из простых веществ. В качестве простых веществ выбирают химические элементы в их естественном фазовом и химическом состоянии при данной температуре.
Энтальпия
образования
может быть определена при любой
температуре. Стандартные энтальпии
образования
![]() соответствуют
реакциям образования, при которых и
простые вещества, и получающееся
соединение находятся при давлении
1 атм (1,01 x 105
Па). По определению, для всех простых
веществ при любой температуре
соответствуют
реакциям образования, при которых и
простые вещества, и получающееся
соединение находятся при давлении
1 атм (1,01 x 105
Па). По определению, для всех простых
веществ при любой температуре
![]() =
0. Для большинства хим. соед. энтальпия
образования-
отрицат. величины.
=
0. Для большинства хим. соед. энтальпия
образования-
отрицат. величины.
Единицы измерения энтальпии образования - Дж/г, Дж/моль.
Энтальпия химической реакции ΔH - это тепловой эффект реакции при постоянном давлении
ΔH = ΔU + pΔV |
Термохимические расчеты:
Основной принцип, на котором основываются все термохимические расчеты, установлен в 1840 г. русским химиком акад. Г. И. Гессом. Этот принцип, известный под названием закона Гесса и являющийся частным случаем закона сохранения энергии, можно сформулировать так:
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Рассмотрим пример, поясняющий закон Гесса. Раствор сульфата натрия можно приготовить из растворов серной кислоты и гидроксида натрия двумя способами:
1.
Смешать раствор, содержащий два моля
![]() ,
с раствором, содержащим один моль
,
с раствором, содержащим один моль
![]() .
.
2.
Смешать раствор, содержащий один моль
![]() ,
с раствором, содержащим один моль
,
с раствором, содержащим один моль
![]() ,
и к полученному раствору кислой соли
,
и к полученному раствору кислой соли
![]() добавить
раствор, содержащий еще один моль
добавить
раствор, содержащий еще один моль
![]() .
.
Запишем термохимические уравнения этих реакций.
![]()
![]()
15 Понятие об энтропии. Термодинамическая вероятность состояния системы. Стандартная энтропия вещества, единицы измерения. Изменение энтропии при химических реакциях и фазовых переходах. Расчет ее изменения.
: энтропия является мерой неупорядоченности состояния системы. Энтропия системы увеличивается во всех процессах, когда возрастает неупорядоченность (нагревание, растворение, испарение, реакции разложения и т.п.) и уменьшается в процессах, идущих с увеличением упорядоченности (охлаждение, кристаллизация, сжатие и т.п.).
Энтропия является функцией состояния, но в отличие от большинства других термодинамических функций возможно экспериментальное определение абсолютного значения энтропии вещества. Эта возможность основана на постулате М.Планка, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю» (третий закон термодинамики).
Энтропию
вещества B в стандартном состоянии
обозначают ![]() .
Для многих веществ абсолютные значения
стандартных энтропий определены и
приводятся в справочных изданиях.
.
Для многих веществ абсолютные значения
стандартных энтропий определены и
приводятся в справочных изданиях.
Энтропия, также как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состоянием системы. Изменение энтропии в ходе химической реакции (2.10) может быть найдено, как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ
![]()
Понятие энтропии используется в одной из формулировок второго закона термодинамики: в изолированных системах могут самопроизвольно протекать только процессы, идущие с увеличением энтропии (ΔS>0). Под изолированными системами понимаются системы, не обменивающиеся с окружающей средой ни веществом, ни энергией. Системы, в которых протекают химические процессы, к изолированным системам не относятся, т.к. они обмениваются с окружающей средой энергией (тепловой эффект реакции).
16 Энергия Гиббса - критерий направления самопроизвольного протекания процессов. Расчет энергии Гиббса как функции состояния системы для химических реакций. Влияние энтальпийного и энтропийного факторов на изменение энергии Гиббса.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
где
![]() —
внутренняя
энергия,
—
внутренняя
энергия,
![]() —
давление,
—
давление,
![]() —
объём,
—
объём,
![]() —
абсолютная температура,
—
абсолютная температура,
![]() —
энтропия.
—
энтропия.
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Запишем обобщённое уравнение первого и второго начал термодинамики:
![]()
При
![]() .
.
![]()
![]()
Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения.
