
- •"Сумма массы в-ва системы и массы, эквивалентной энергии, которая получена или отдана этой системой постоянна."
- •Концентрация
- •Давление
- •Билет34.Электродный потенциал. Зависимость от усл провед р-ции. Ур-ие Нернста.
- •Билет 35. Направление протекания овр. Вычисление дельта е0 и д е на примере. Кр овр.
- •Билет36. Электролиз,хим.Ист тока.Совр гальв эл-ты.Топливн эл-т.
- •Билет37.Квантовое описание строения атома. Атомные орбитали и кантовые числа. Графическое представление атомных орбиталей. Порядок заполнения атомных орбиталей в многоэлектронных атомах.
- •Билет38.Эн диаграммы многоэлектронных атомов и пс дим.Свва атомов радиус, Еионизации, сродство к е, эо
- •Билет39.Образование хим свзяи, ее хар-ки:энергия,длина,полярность.Перекрывание ао с обр сигма и пи свзяи. Описание ков хим связи с пом метода мо..
- •Билет41. Эн диаграммы гомояд молекул 2 периода.Законом в имз св-в(Есв,длина,магн св-ва)
- •Билет42. Применение метода лкао-мо для опис обр св в гетерояд двухат мол-лах на примере cj, LiH NaF. Полярность связи.
- •Билет43. ГеомПредсказание геометрии мол-л методом отталкивания е пар(Метод Гиллеспи).ГеометрияBeCl2,bf3,ch4,nh3,h2o.
- •Билет44 в-ва с мол стр(ех-s). Межмол взаим.. 3 Сост сил Ван-Дер-Ваальса(вдв).Водор св.Особенности hf, h2o,nh3,обусловл водор св.
- •Билет47. Химическая связь в комплексе методом мо.( октаэдр компл 3d-м).Е расщепл и природа лиганда. Низко/высокоспиновые компл.
- •Билет48. Реакции с комплексами:ркии замещения лигандов, с изм со комплексообр, рции в которые вступают координировнанные лиганды( примеры)
Билет41. Эн диаграммы гомояд молекул 2 периода.Законом в имз св-в(Есв,длина,магн св-ва)
У элтов 2 пер валент 4 орб — одна 2s и три 2р. Линейные комбинации 2р-орбиталей образуют молекулярные орбитали сигма- и пи-типа.
Отметим, что сгма,п-связывающая МО является не суммой, а разностью р-орбиталей двух атомов, так как только в этом случае р-орбитали имеют в области перекрывания одинаковый знак.
В двухат гомояд мол-лах 2 пер, обр 8 МО, 4 сигма 4 пи.индекс р или s(кто образовал) у пи – ось р-орб Разрых-*сигма св выгоднее, поэтому расс меду сигмаs и сигма s*
Иметь
ввиду-в обр Мо сигма типа уч р и s
орб.поэтому на диагр несимм(у них Е
разная) Так, за счет "примеси" 2р-А0
энергия МО сигма -s понижается сильнее,
чем повышается энергия МО сигма –s
разрыхляющая, а вклад 2s-A0 увеличивает
энергию молекулярной орбитали сигма-р
настолько, что она оказывается больше,
чем энергия МО пи –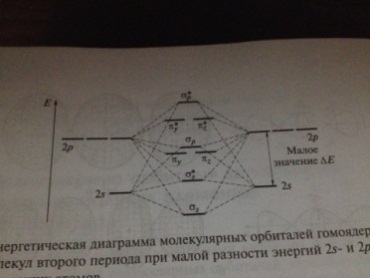 у
и пи -z.
у
и пи -z.
Если разность Е s р АО большая, то у пара сигма св-только s орб, а друг-только р. Но такое только у фтора и кислорода.
Метод Мо лучше обьясн экпсп уст Е связи. Так, крайне малая величина энергии связи в молекуле Ве2 хорошо согласуется с краткостью связи равной нулю, в то время как метод электронных пар позволяет предположить для этой молекулы формулу Ве=Ве с двойной связью между атомами.
Для молекулы В2 метод электронных пар двает молекулу с тройной св, кажется, что она прочная.. Это не так, Е св небольшая, кт кратность=1. Однако следует подчеркнуть, что между кратностью связи и ее энергией нет однозначной взаимосвязи энергии образования молекул В2 и Li2 различаются почти в 3 раза при одинаковой кратности связи. Е св звисит от эфф перекр и взаим отталк е. ех, 14 вал е у f2 отталк, а радиус мал=> низная Е св и высок реакц спос-ть.Метод молекулярных орбиталей объясняет также магнитные свойства молекул В2 и 02. Эти молекулы имеют неспаренные электроны и поэтому взаимодействуют с магнитным полем, Т. е. являются парамагнитными.
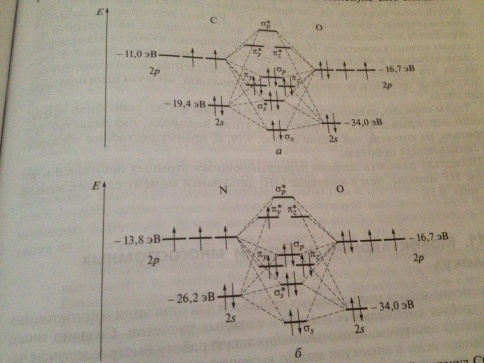
Билет42. Применение метода лкао-мо для опис обр св в гетерояд двухат мол-лах на примере cj, LiH NaF. Полярность связи.
МО-ЛКАО- Мо как линейн комб АО.Строить гетереяд сложнее, тк св зависит не только от перекр, но и от разности Е орб.Ограничиимся 2 типами:
1)Взаимодействующие атомы А и В близки по электроотрицательности и энергии их валентных АО различаются не очень сильно.
2)Один из взаимодействующих атомов намного более электроотрицателен, чем другой, поэтому энергии всех валентных орбиталей первого атома значительно меньше, чем второго.
1)эн
диаграммы похожи на эн диаграммы гомояд
мол-л.разница-более Эо больший вклад
–в связ МО, менее-в разрыхл. Пример-СО,
NO.В
СО кратность 3, это обьясняет ее самую
большую Е св среди двухат мол-л.В NO
кратность равна 2,5 , 1 е на разрых легко
отрыв превращ в NO+,
у него кратн=3, Е св больше чем у N2.
2)В LiH принимают уч-е 1s Н b 2s лития. Разница в Е 8,3 эВ.разность р и s слишком большая поэтому она не уч-ет. Оба е на свя орбитали, больший вклад о н(Е меньше)Поэтому электронная плотность в молекуле LН смещена в сторону атома Н, а сама молекула имеет значительный дипольный момент.
В HF разность между 1s у Н и 2s у F 29,2 ЭВ, поэтому св обр между 2р и 1s. 1s F остаютс несвязывающ., буква n.та же Е.Ед орбиталь. Которая может у F СС Н перекрыв-рх, преимущ из нее связь и получ. Разность Е перекр орб у HF <, и дипольн мом <.

