
- •Часть 1
- •Содержание
- •Раздел 1. Механика
- •Тема 1. Кинематика
- •Основные понятия
- •Тема 2. Динамика
- •Основные понятия
- •Тема 3. Законы сохранения
- •Основные понятия
- •Раздел 2. Молекулярная физика
- •Тема 1. Основы молекулярно - кинетической теории
- •Тема 2. Основы термодинамики
- •Основные понятия
- •Введение Основные понятия
- •Измерения физической величины
- •Международная система единиц си
- •Погрешности при измерении величины
- •Раздел 1. Механика
- •Тема 1. Кинематика Основные понятия
- •Основные характеристики механического движения
- •Векторы и их проекции на координатные оси
- •Сложение векторов
- •Проекции вектора перемещения на координатные оси и координаты материальной точки
- •Виды механического движения
- •Равномерное прямолинейное движение
- •Неравномерное прямолинейное движение
- •Равнопеременное прямолинейное движение
- •Законы движения
- •Графики движения
- •Графики ускорения
- •Относительность механического движения
- •Формула сложения скоростей
- •Равномерное движение по окружности
- •Тема 2. Динамика Основные понятия
- •Основные законы и принципы
- •Проявления силы упругости.
- •Тема 3. Законы сохранения Основные понятия
- •Основные законы
- •Раздел 2. Молекулярная физика
- •Тема 1. Основы молекулярно - кинетической теории Основные положения мкт
- •Некоторые опытные обоснования этих положений
- •Основные понятия мкт
- •1.Абсолютная масса молекулы ( )
- •5.Масса вещества ( : n;
- •6.Число молекул или атомов( : ; Агрегатные состояния вещества (фазы вещества)
- •Молекулярно – кинетическая теория газов
- •Основное уравнение мкт идеального газа
- •Связь температуры по шкале Кельвина с температурой по шкале Цельсия
- •Скорость теплового движения молекул
- •Уравнение состояния идеального газа (уравнение Клапейрона – Менделеева)
- •Уравнение Клапейрона (объединённый газовый закон)
- •Газовые законы
- •Молекулярно – кинетическая теория жидкостей
- •Смачивание
- •Капиллярность
- •Молекулярно – кинетическая теория твёрдого тела
- •Кристаллические тела
- •Механические свойства твёрдых тел
- •Тепловое расширение тел
- •Фазовые переходы
- •Насыщенный и ненасыщенный пар
- •Критическое состояние
- •Кипение
- •Влажность воздуха
- •Плавление и кристаллизация
- •Тема 2. Основы термодинамики
- •Основные понятия термодинамики
- •Внутренняя энергия
- •Количество теплоты
- •Работа газа Внутренняя энергия
- •Количество теплоты
- •Работа в термодинамике
- •Законы термодинамики
- •Первый закон термодинамики для изопроцессов
- •Изотермический процесс:
- •Адиабатный процесс
- •Второй закон термодинамики
- •Тепловые двигатели
Основные понятия мкт
1.Абсолютная масса молекулы ( )
Абсолютная
масса молекулы или просто масса молекулы
вещества очень мала, например,
(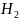 O)
O)
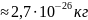 .
.
2.Относительная
молекулярная масса (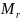 )
– отношение
массы молекулы данного вещества к
)
– отношение
массы молекулы данного вещества к
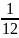 массы атома
углерода
:
=
массы атома
углерода
:
=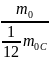 ;
;
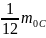 =
=
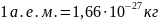 (
( - атомная единица массы).
- атомная единица массы).
Зная
химическую формулу вещества, можно
найти относительную молекулярную массу
как сумму относительных масс атомов,
из которых состоит молекула. Относительные
атомные массы веществ берутся в таблице
Менделеева. Например,
( )
= 16 ·2 =32;
(
)
= 16 ·2 =32;
(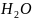 )
=1·2 + 16 =18.
)
=1·2 + 16 =18.
3.Количество
вещества (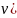 – отношение
числа молекул данного вещества к
постоянному числу Авогадро
– отношение
числа молекул данного вещества к
постоянному числу Авогадро
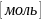 :
:
 ;
;
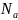 – постоянная
Авогадро показывает, сколько молекул
содержится в одном моле любого вещества,
=
– постоянная
Авогадро показывает, сколько молекул
содержится в одном моле любого вещества,
=

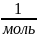 .
.
Моль – количество вещества, содержащееся в 12г углерода.
4.Молярная
масса вещества (
)
– масса
одного моля вещества
 :
:
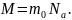 Молярную
массу можно найти, зная, что
=
Молярную
массу можно найти, зная, что
= кг/моль.
Например,
кг/моль.
Например,
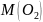 =
=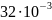 кг/моль;
кг/моль;
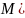 O)
= 18
O)
= 18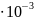 кг/моль.
кг/моль.
5.Масса вещества ( : n;
6.Число молекул или атомов( : ; Агрегатные состояния вещества (фазы вещества)
твёрдое жидкое газообразное плазменное
Фазовый переход – переход вещества из одного агрегатного состояния в другое.
Например, при нагревании твёрдое вещество можно перевести в жидкое состояние, жидкое в газообразное, а газ в плазменное состояние. Плазма – это частично или полностью ионизированный газ, т. е. электронейтральная система, состоящая из нейтральных атомов и заряженных частиц (ионов, электронов и т. д.)
В молекулярной физике изучаются три фазы состояния вещества: газ, жидкость и твердое тело. Основные свойства газов: 1. не имеют постоянного объёма, занимают весь предоставленный, неограниченно расширяясь; 2. не имеют постоянной формы, принимают форму сосуда; 3. легко сжимаются; 4. оказывают давление на все стенки сосуда.
Основные свойства жидкостей: 1. сохраняют постоянный объём; 2. не имеют постоянной формы, принимают форму сосуда; 3. практически не сжимаемы; 4. текучи.
Основные свойства твёрдых тел: 1. имеют постоянный объём; 2. сохраняют постоянную форму; 3. имеют правильную геометрическую форму кристаллов.
Свойства веществ в различных агрегатных состояниях можно объяснить, зная особенности их внутреннего строения.
Агрегатное состояние |
Расстояние между частицами |
Взаимодействие частиц |
Характер движения частиц |
Порядок в расположении частиц |
Газы |
Много больше размеров частиц |
Слабое притяжение, отталкивание только при соударениях |
Свободное, поступательное, хаотичное движение с большими скоростями - «бродяги» |
Нет порядка |
Жидкости |
Сравнимо с размерами частиц |
Сильное притяжение и отталкивание |
Колебательно-поступательное движение, т.е. колеблются около положения равновесия и могут перескакивать – «кочевники» |
Порядок не строгий – «ближний» порядок |
Твёрдые тела |
Меньше размеров частиц, «плотная упаковка» |
Сильное притяжение и отталкивание (сильнее, чем в жидкости) |
Ограниченное, совершают колебания около положения равновесия – «оседлые» |
Строгий порядок – «дальний» порядок (кристаллическая решётка) |
