
- •1. Предмет физической и коллоидной химии
- •2. Понятие об агрегатн сост в-ва.Переходы.Жидкое строение
- •3. Строение твёрдых тел. Кристалич и аморф. Стекл и кристалл сост в-ва.
- •4. Строение и макроскопические свойства кристаллов.
- •5. Типы кристалич решеток. Типы связей и кристалич. Структуры.
- •6. Реальные кристаллы.Основные типы дефектов в реальных кристаллах. Влияние дефектов.
- •8. Предмет и основные понятия термодин. 1 з-н термодинамики
- •9. Термохимия. Термохим уравнения. Станд теплов эффекты.Тепловые эффекты разл процессов.
- •11. Второй з-н термодинамики. Энтропия. Станд энтропии.Изменение
- •12. Изобарно-изотерм. Потенциал. Критерии осуществ.
- •13. Энтропийный и энтальпийный факторыв направлении процесса. Зависимость энерг.Гиббса от t. Стандартн изменения.
- •14. Обратимые хим. Процессы Принцип равновесия Гиббса.Сост равн сист.
- •15.Особенности хим равновесия. Признаки и критерии. Константа хим равновесия.
- •16. Принцип Ле Шателье. Влияние разл факторов на хим равновесие.
- •17. Термодинамика фазовых переходов. Основные понятия. Правило фаз Гиббса.
- •18. Уравнение Клаузиуса – Клапейрона. З-н распределения Нернста. Активность растворённых веществ.
- •19. Понятие о диаграммах состояния. Однокомп. Системы.
- •32. Скорость и порядок химической реакции. Зависимость с от t.
- •33. Зависимость концентр от времени и период полупревращения для реакции 1 и 2 порядка
- •34. Зависимость скорости гомогенных реакций от температуры. Правило Вант-Гоффа
- •35. Энергия активации. Уравнение Аррениуса. Влияние давления
- •36. Общие понятия катализа. Гомогенный катализ
- •37. Гетерогенный катализ.
- •38. Адсорбция и её роль в гетерогенномкатализе
- •39. Особенности реакций в твердой фазе
- •40. Процессы диффузии в твёрдых телах
- •41. Кинетика твёрдофазовых реакций. Реакции 1 и 2 типа(нету)
- •42. Общие понятия электрохимии. Электродные потенциалы. Механизм их возникновения.
- •43. Зависимость эл потенц от природы электролитов. Уравнение Нернста. Расчет.
- •44. Теория гальванических элементов.
- •45. Электролиз. Виды электролиза. Законы Фарадея.
- •46. Коррозия металлов. Классификация. Химическая коррозия.
- •47. Электрохимическая коррозия.Скорость.Кислород
- •48. Основные методы защиты металлов от коррозии. Защитные покрытия. Электрохимическая защита.
- •49. Дисперсные системы. Классификация дисперсных систем. Оптические с-ва дисперсных систем.
13. Энтропийный и энтальпийный факторыв направлении процесса. Зависимость энерг.Гиббса от t. Стандартн изменения.
Протекание
любой химической реакции в
изобарно-изотермической условиях
определяется двумя факторами. Первый
фактор – энтальпийный ( )
– определяет изменение энергии системы.
Второй фактор – энтропийный (
)
– определяет изменение энергии системы.
Второй фактор – энтропийный ( )
– определяет изменение неупорядоченности
системы. Таким образом, протеканию
химической реакции способствует
уменьшение энергии системы и переход
ее в более неупорядоченное состояние.
)
– определяет изменение неупорядоченности
системы. Таким образом, протеканию
химической реакции способствует
уменьшение энергии системы и переход
ее в более неупорядоченное состояние.
Энергия
Гиббса связана с энтальпией и энтропией:
 .
В любой закрытой системе при постоянном
давлении и температуре возможен такой
самопроизвольный процесс, который ведет
к уменьшению энергии Гиббса. Следовательно,
условием принципиальной возможности
протекания химической реакции является
неравенство:
.
В любой закрытой системе при постоянном
давлении и температуре возможен такой
самопроизвольный процесс, который ведет
к уменьшению энергии Гиббса. Следовательно,
условием принципиальной возможности
протекания химической реакции является
неравенство:
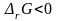 .
В случае, когда
.
В случае, когда
 ,
самопроизвольное протекание реакции
невозможно. Если
,
система находится в состоянии химического
равновесия.
,
самопроизвольное протекание реакции
невозможно. Если
,
система находится в состоянии химического
равновесия.
Вклады
энтропийного и энтальпийного факторов
значительно зависит от температуры.
При
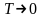
 и
и
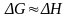 .
.
Доминирующим становиться энтальпийный фактор, поэтому при низких температурах, как правило, протекают самопроизвольно экзотермические реакции.
При

 и
и
 .
.
Доминирующим становится энтропийный фактор, поэтому при высоких температурах , как правило, самопроизвольно протекают реакции, ведущие к увеличению энтропии.
Таким образом, при анализе возможности самопроизвольного протекания химической реакции необходим одновременный учет энтальпийного и энтропийного факторов.
Изменение энергии гиббса в ходе химической реакции можно рассчитать как разность между суммой стандартных энергий гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
 , (2.45)
, (2.45)
где ν – стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
Следует помнить, что стандартная энергии Гиббса образования простых веществ, находящихся в наиболее устойчивом в стандартных условиях фазовом состоянии, равна нулю.
14. Обратимые хим. Процессы Принцип равновесия Гиббса.Сост равн сист.
Обратимые и необратимые процессы. Обратимые – процессы, допускающие возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
Расчёт энтропии для равновесных (обратимых) процессов.
Второй
закон термодинамики в виде
 ,
записанный для равновесных процессов,
позволяет вычислить не абсолютное
значение энтропии, а только разность
энтропий в двух состояниях системы.
,
записанный для равновесных процессов,
позволяет вычислить не абсолютное
значение энтропии, а только разность
энтропий в двух состояниях системы.
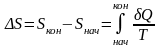 .
Изотермические процессы
(T = const).
.
Изотермические процессы
(T = const).
При
постоянной температуре протекают
процессы фазовых превращений веществ:
плавление, испарение и другие. При
равновесном протекании этих процессов
давление сохраняется обычно постоянным,
поэтому
 и
и
 ,
б) Изобарные процессы
(р = const).
,
б) Изобарные процессы
(р = const).
Если нагревание происходит при постоянном давлении, то
 ,
где n – число молей вещества. Тогда
,
где n – число молей вещества. Тогда
 .
с) Изохорные процессы
(V = const).
.
с) Изохорные процессы
(V = const).
Если нагревание происходит при постоянном объёме, то
 .
.
Тогда
 .
Близкой к изохорно-изотермическому
потенциалу является функция, определяющая
направление и предел самопроизвольного
протекания процессов для систем,
находящихся при постоянных температуре
и давлении. Эта функция называется
изобарно-изотер-мическим потенциалом
или энергией
Гиббса,
обозначается символом G и определяется
как
.
Близкой к изохорно-изотермическому
потенциалу является функция, определяющая
направление и предел самопроизвольного
протекания процессов для систем,
находящихся при постоянных температуре
и давлении. Эта функция называется
изобарно-изотер-мическим потенциалом
или энергией
Гиббса,
обозначается символом G и определяется
как
G = H – TS.
или
G = U – TS + pV = F + pV.
1). Система
при T, V = const
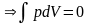 ,
т. е. ΔF ≤ 0.
Условие равновесия в изохорно-изотермической
системе: dF = 0,
ΔF = 0,
F
= Fmin.
,
т. е. ΔF ≤ 0.
Условие равновесия в изохорно-изотермической
системе: dF = 0,
ΔF = 0,
F
= Fmin.
2). Система
при р, T = const. Тогда
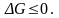 Условие равновесия в изобарно-изотерми-ческой
системе: dG = 0,
ΔG = 0,
G
= Gmin.
Условие равновесия в изобарно-изотерми-ческой
системе: dG = 0,
ΔG = 0,
G
= Gmin.
