
- •1. Предмет физической и коллоидной химии
- •2. Понятие об агрегатн сост в-ва.Переходы.Жидкое строение
- •3. Строение твёрдых тел. Кристалич и аморф. Стекл и кристалл сост в-ва.
- •4. Строение и макроскопические свойства кристаллов.
- •5. Типы кристалич решеток. Типы связей и кристалич. Структуры.
- •6. Реальные кристаллы.Основные типы дефектов в реальных кристаллах. Влияние дефектов.
- •8. Предмет и основные понятия термодин. 1 з-н термодинамики
- •9. Термохимия. Термохим уравнения. Станд теплов эффекты.Тепловые эффекты разл процессов.
- •11. Второй з-н термодинамики. Энтропия. Станд энтропии.Изменение
- •12. Изобарно-изотерм. Потенциал. Критерии осуществ.
- •13. Энтропийный и энтальпийный факторыв направлении процесса. Зависимость энерг.Гиббса от t. Стандартн изменения.
- •14. Обратимые хим. Процессы Принцип равновесия Гиббса.Сост равн сист.
- •15.Особенности хим равновесия. Признаки и критерии. Константа хим равновесия.
- •16. Принцип Ле Шателье. Влияние разл факторов на хим равновесие.
- •17. Термодинамика фазовых переходов. Основные понятия. Правило фаз Гиббса.
- •18. Уравнение Клаузиуса – Клапейрона. З-н распределения Нернста. Активность растворённых веществ.
- •19. Понятие о диаграммах состояния. Однокомп. Системы.
- •32. Скорость и порядок химической реакции. Зависимость с от t.
- •33. Зависимость концентр от времени и период полупревращения для реакции 1 и 2 порядка
- •34. Зависимость скорости гомогенных реакций от температуры. Правило Вант-Гоффа
- •35. Энергия активации. Уравнение Аррениуса. Влияние давления
- •36. Общие понятия катализа. Гомогенный катализ
- •37. Гетерогенный катализ.
- •38. Адсорбция и её роль в гетерогенномкатализе
- •39. Особенности реакций в твердой фазе
- •40. Процессы диффузии в твёрдых телах
- •41. Кинетика твёрдофазовых реакций. Реакции 1 и 2 типа(нету)
- •42. Общие понятия электрохимии. Электродные потенциалы. Механизм их возникновения.
- •43. Зависимость эл потенц от природы электролитов. Уравнение Нернста. Расчет.
- •44. Теория гальванических элементов.
- •45. Электролиз. Виды электролиза. Законы Фарадея.
- •46. Коррозия металлов. Классификация. Химическая коррозия.
- •47. Электрохимическая коррозия.Скорость.Кислород
- •48. Основные методы защиты металлов от коррозии. Защитные покрытия. Электрохимическая защита.
- •49. Дисперсные системы. Классификация дисперсных систем. Оптические с-ва дисперсных систем.
11. Второй з-н термодинамики. Энтропия. Станд энтропии.Изменение
Любой химический процесс можно представить как сокупность двух явлений: во–первых, передачи энергии, во–вторых, изменение упорядоченности во взаимном расположении частиц. Качественно охарактеризовать рассеивание тепловой энергии призвана энтропия, которая обозначается символом S. Энтропия – мера неупорядоченности системы. При переходе системы из более упорядоченного состояния в менее упорядоченное состояние энтропия системы возрастает, а при переходе системы из менее упорядоченного в более упорядоченное состояние энтропия системы уменьшается.
Существует несколько формулировок второго закона термодинамики:
1. Формулировка по Клаузиусу. Теплота не может самопроизвольно переходить от более холодного тела к более горячему.
2. Формулировка по Оствальду. Вечный двигатель второго рода невозможен (т.е. не существует машины, которая бы полностью превращала теплоту в работу).
3. Формулировка по Томсону. Невозможно получать работу при наличии только одного источника тепла в циклически действующей машине.
второй закон термодинамики гласит: в изолированной системе самопроизвольно протекает только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии. Основной смысл этого закона состоит в том, что в любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, а, значит, и рост энтропии.
: существует функция состояния S – энтропия, которая следующим образом связана с теплотой, поступающей в систему, и температурой системы:
1. 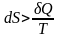 – для самопроизвольных процессов;
– для самопроизвольных процессов;
2. 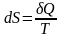 – для обратимых (равновесных) процессов;
– для обратимых (равновесных) процессов;
3.  – для несамопроизвольных процессов, В
изолированной системе (δQ = 0)
и изменение энтропии служит критерием
направления процесса, т. е. является
критерием обратимости и необратимости
процессов: если в процессе dS
> 0, то он самопроизволен, необратим, а
если dS
= 0, то он равновесный, обратимый. Энтропия
изолированной системы или увеличивается,
или остаётся постоянной, и в состоянии
равновесия энтропия максимальна:
Su,v = Smax
и (∆S)u,v = 0.
– для несамопроизвольных процессов, В
изолированной системе (δQ = 0)
и изменение энтропии служит критерием
направления процесса, т. е. является
критерием обратимости и необратимости
процессов: если в процессе dS
> 0, то он самопроизволен, необратим, а
если dS
= 0, то он равновесный, обратимый. Энтропия
изолированной системы или увеличивается,
или остаётся постоянной, и в состоянии
равновесия энтропия максимальна:
Su,v = Smax
и (∆S)u,v = 0.
Если рассматривают влияние температуры (обобщенной силы) при постоянстве других интенсивных параметров на химическое равновесие, то в качестве сопряженной координаты используют тепловой эффект реакции. Чем больше по величине тепловой эффект реакции, тем сильнее влияет на положение равновесия изменение температуры. При изменении давления – обобщенной силы – сопряженной обобщенной координатой будет изменение объёма в ходе реакции, взятое с обратным знаком. Стандартный изобарный потенциал химической реакции (или химическое сродство веществ) равен изобарному потенциалу химической реакции

12. Изобарно-изотерм. Потенциал. Критерии осуществ.
Уравнение изотермы (или просто изотерма) химической реакции позволяет связать возможное направление химической реакции с исходным составом реагирующих веществ. При исследовании химических процессов чаще пользуются величиной G, которая является индикатором реакционной способности веществ в процессах при Т, р = const.
Изменение энергии Гиббса в ходе протекания химической реакции между газообразными веществами равно

При
наступлении равновесия в системе
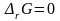 ,
тогда
,
тогда
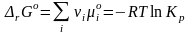 ,
, , где
pi
— начальные (заданные) парциальные
давления участников реакции.
, где
pi
— начальные (заданные) парциальные
давления участников реакции.
Последние уравнения называют уравнениями изотермы химической реакции или уравнениями Вант–Гоффа. Они выражают зависимость rG от состава системы, т. е. зависимость между термодинамическим потенциалом реакции rG, константой химического равновесия (Кp) и условиями проведения реакции. Стандартный изобарный потенциал химической реакции (или химическое сродство веществ) равен изобарному потенциалу химической реакции
при условии, что парциальные давления всех веществ, учавствующих в реакции, равны рo = 1 атм = 101325 Па.
В общем случае (для реальных и идеальных систем) справедливо:
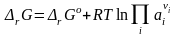 ,
,
