
- •1. Предмет физической и коллоидной химии
- •2. Понятие об агрегатн сост в-ва.Переходы.Жидкое строение
- •3. Строение твёрдых тел. Кристалич и аморф. Стекл и кристалл сост в-ва.
- •4. Строение и макроскопические свойства кристаллов.
- •5. Типы кристалич решеток. Типы связей и кристалич. Структуры.
- •6. Реальные кристаллы.Основные типы дефектов в реальных кристаллах. Влияние дефектов.
- •8. Предмет и основные понятия термодин. 1 з-н термодинамики
- •9. Термохимия. Термохим уравнения. Станд теплов эффекты.Тепловые эффекты разл процессов.
- •11. Второй з-н термодинамики. Энтропия. Станд энтропии.Изменение
- •12. Изобарно-изотерм. Потенциал. Критерии осуществ.
- •13. Энтропийный и энтальпийный факторыв направлении процесса. Зависимость энерг.Гиббса от t. Стандартн изменения.
- •14. Обратимые хим. Процессы Принцип равновесия Гиббса.Сост равн сист.
- •15.Особенности хим равновесия. Признаки и критерии. Константа хим равновесия.
- •16. Принцип Ле Шателье. Влияние разл факторов на хим равновесие.
- •17. Термодинамика фазовых переходов. Основные понятия. Правило фаз Гиббса.
- •18. Уравнение Клаузиуса – Клапейрона. З-н распределения Нернста. Активность растворённых веществ.
- •19. Понятие о диаграммах состояния. Однокомп. Системы.
- •32. Скорость и порядок химической реакции. Зависимость с от t.
- •33. Зависимость концентр от времени и период полупревращения для реакции 1 и 2 порядка
- •34. Зависимость скорости гомогенных реакций от температуры. Правило Вант-Гоффа
- •35. Энергия активации. Уравнение Аррениуса. Влияние давления
- •36. Общие понятия катализа. Гомогенный катализ
- •37. Гетерогенный катализ.
- •38. Адсорбция и её роль в гетерогенномкатализе
- •39. Особенности реакций в твердой фазе
- •40. Процессы диффузии в твёрдых телах
- •41. Кинетика твёрдофазовых реакций. Реакции 1 и 2 типа(нету)
- •42. Общие понятия электрохимии. Электродные потенциалы. Механизм их возникновения.
- •43. Зависимость эл потенц от природы электролитов. Уравнение Нернста. Расчет.
- •44. Теория гальванических элементов.
- •45. Электролиз. Виды электролиза. Законы Фарадея.
- •46. Коррозия металлов. Классификация. Химическая коррозия.
- •47. Электрохимическая коррозия.Скорость.Кислород
- •48. Основные методы защиты металлов от коррозии. Защитные покрытия. Электрохимическая защита.
- •49. Дисперсные системы. Классификация дисперсных систем. Оптические с-ва дисперсных систем.
38. Адсорбция и её роль в гетерогенномкатализе
На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата. Теории адсорбции Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому некоторые наиболее распространенные теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело – газ или твердое тело – раствор. Теория мономолекулярной адсорбции Лэнгмюра
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
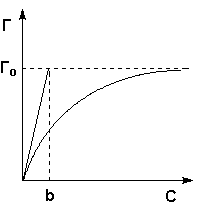
При описании процесса адсорбции газов в уравнении (IV.13) концентрация может быть заменена пропорциональной величиной парциального давления газа:
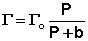
39. Особенности реакций в твердой фазе
ХИМИЯ ТВЁРДОГО ТЕЛА (химия твердого состояния), раздел физ. химии, изучающий строение, св-ва и методы получения твердых в-в. X. т. т. связана с физикой твердого тела, кристаллографией, минералогией, физ.-хим. механикой, механохимией, радиационной химией, является основой технологии неорг., полимерных и композиц. материалов.
Основные задачи X. т. т.: установление взаимосвязи структуры твердых тел с их св-вами, обоснование путей создания материалов с улучшенными эксплуатационными св-вами, разработка теории строения и реакц. способности твердых тел.
В X. т. т. используется особый набор методов исследования (дифракционные методы, электронная микроскопия и др.).
На св-ва и поведение твердых тел влияют также состояние твердого тела (кристаллическое или аморфное), тип кристаллич. модификации, наличие и характер фазовых переходов.
Р-ции твердых тел носят топохим. характер (см. Топонимические реакции)и зачастую определяются скоростью диффузии в твердых телах. Диффузия здесь отличается от диффузии в газах и жидкостях: она может протекать на внешней пов-сти, по границам кристаллитов, в объеме твердого тела и характеризуется высокими значениями кажущейся энергии активации.
Одна из важнейших концепций в кинетике твердофазных р-ций (введена С. Хиншелвудом в 1925) состоит в протекании процессов в результате последовательного образования и роста на пов-сти или в объеме исходной фазы зародышей новой твердой фазы.
В Х. т. т. используется очень широкий набор методов синтеза - с применением низких и сверхвысоких т-р, рекордно высоких давлений и сверхглубокого вакуума, сильнейших центробежных полей, разнообразных физ. методов активирования процессов, при полном отсутствии гравитации. См., напр., Реакции в твердых телах, Самораспространяющийся высокотемпературный синтез.
Важными этапами в развитии X. т. т. явилось создание совр. методов выращивания монокристаллов больших размеров (см. Монокристаллов выращивание)из расплава, из перегретых водных р-ров (см. Гидротермальные процессы), разработка процесса выращивания по механизму пар - жидкость -кристалл, методов зонной плавки кристаллов, методов управления св-вами кристалла путем наложения при его выращивании магнитных и электрич. полей. Значительное место в Х. т. т. занимает получение и исследование св-в пленок и покрытий.
Новую область в X. т. т. открыло создание методов получения аморфных твердых материалов путем химического осаждения из газовой фазы с плазменной активацией. Таким путем получены необычные "сплавы" полупроводниковых элементов с водородом, фтором, азотом и др. легкими элементами, тройные и более сложные композиции, многие из к-рых обладают уникальными св-вами и имеют широкие перспективы практич. применения. Основой микроэлектроники является планарная технология, разработанная в США в 1959.
