
- •1. Предмет физической и коллоидной химии
- •2. Понятие об агрегатн сост в-ва.Переходы.Жидкое строение
- •3. Строение твёрдых тел. Кристалич и аморф. Стекл и кристалл сост в-ва.
- •4. Строение и макроскопические свойства кристаллов.
- •5. Типы кристалич решеток. Типы связей и кристалич. Структуры.
- •6. Реальные кристаллы.Основные типы дефектов в реальных кристаллах. Влияние дефектов.
- •8. Предмет и основные понятия термодин. 1 з-н термодинамики
- •9. Термохимия. Термохим уравнения. Станд теплов эффекты.Тепловые эффекты разл процессов.
- •11. Второй з-н термодинамики. Энтропия. Станд энтропии.Изменение
- •12. Изобарно-изотерм. Потенциал. Критерии осуществ.
- •13. Энтропийный и энтальпийный факторыв направлении процесса. Зависимость энерг.Гиббса от t. Стандартн изменения.
- •14. Обратимые хим. Процессы Принцип равновесия Гиббса.Сост равн сист.
- •15.Особенности хим равновесия. Признаки и критерии. Константа хим равновесия.
- •16. Принцип Ле Шателье. Влияние разл факторов на хим равновесие.
- •17. Термодинамика фазовых переходов. Основные понятия. Правило фаз Гиббса.
- •18. Уравнение Клаузиуса – Клапейрона. З-н распределения Нернста. Активность растворённых веществ.
- •19. Понятие о диаграммах состояния. Однокомп. Системы.
- •32. Скорость и порядок химической реакции. Зависимость с от t.
- •33. Зависимость концентр от времени и период полупревращения для реакции 1 и 2 порядка
- •34. Зависимость скорости гомогенных реакций от температуры. Правило Вант-Гоффа
- •35. Энергия активации. Уравнение Аррениуса. Влияние давления
- •36. Общие понятия катализа. Гомогенный катализ
- •37. Гетерогенный катализ.
- •38. Адсорбция и её роль в гетерогенномкатализе
- •39. Особенности реакций в твердой фазе
- •40. Процессы диффузии в твёрдых телах
- •41. Кинетика твёрдофазовых реакций. Реакции 1 и 2 типа(нету)
- •42. Общие понятия электрохимии. Электродные потенциалы. Механизм их возникновения.
- •43. Зависимость эл потенц от природы электролитов. Уравнение Нернста. Расчет.
- •44. Теория гальванических элементов.
- •45. Электролиз. Виды электролиза. Законы Фарадея.
- •46. Коррозия металлов. Классификация. Химическая коррозия.
- •47. Электрохимическая коррозия.Скорость.Кислород
- •48. Основные методы защиты металлов от коррозии. Защитные покрытия. Электрохимическая защита.
- •49. Дисперсные системы. Классификация дисперсных систем. Оптические с-ва дисперсных систем.
18. Уравнение Клаузиуса – Клапейрона. З-н распределения Нернста. Активность растворённых веществ.
В системе, состоящей из нескольких фаз чистого вещества, возможны переходы вещества из одной фазы в другую. Такие переходы называют фазовыми переходами. Фазовые переходы характеризуются зависимостью температуры фазового превращения от внешнего давления или давления насыщенного пара от температуры системы. Уравнение, характеризующее такие зависимости, предложено Клапейроном и и позже модифицировано Клаузиусом.
Пусть 1 моль вещества равновесно переходит из одной фазы (1) в другую (2) при р, Т = const. Ограничимся рассмотрением фазовых переходов первого рода, для которых характерно равенство изобарных потенциалов двух фаз и скачкообразное изменение энтропии S и объёма V. К фазовым переходам первого рода относятся следующие изотермические переходы:
 (испарение),
(испарение),
 (сублимация),
(сублимация), (плавление, кристаллизация).
(плавление, кристаллизация).
Условием равновесием является равенство мольных энергий Гиббса вещества в двух фазах: G1 = G2. Если р и Т одновременно изменяются на dp и dT,то G тоже изменится на dG и новое условие равновесия запишется как
 , (4.11)
, (4.11)
 , (4.12)
, (4.12)
Из
соотношения (2.40)
 следует, что и
следует, что и ,
,
 , (4.13)
, (4.13)
 ,
т. е.
,
т. е.
 . (4.14)
. (4.14)
С
учетом того, что ,
,
 ,
где V
= V2
– V1
— разность мольных объёмов двух фаз,
S
и H
– изменение энтропии и энтальпии
вещества при переходе 1 моля вещества
из одной фазы (1) в другую (2). Уравнение
(4.16) называют уравнением
Клапейрона–Клаузиуса.
Оно устанавливает связь между изменением
температуры фазового перехода с
изменением внешнего давления или
изменением давления насыщенного пара
с изменением температуры, с одной
стороны, и теплотой фазового перехода
и изменением объёма вещества при фазовом
переходе, с другой стороны.
,
где V
= V2
– V1
— разность мольных объёмов двух фаз,
S
и H
– изменение энтропии и энтальпии
вещества при переходе 1 моля вещества
из одной фазы (1) в другую (2). Уравнение
(4.16) называют уравнением
Клапейрона–Клаузиуса.
Оно устанавливает связь между изменением
температуры фазового перехода с
изменением внешнего давления или
изменением давления насыщенного пара
с изменением температуры, с одной
стороны, и теплотой фазового перехода
и изменением объёма вещества при фазовом
переходе, с другой стороны.
В смеси двух жидкостей, нерастворимых или ограниченно растворимых одна в другой, образуются два слоя (или чистые компоненты, или растворы жидкостей). Если в такую систему добавить третье вещество, растворимое в обоих жидкостях, то после достижения равновесия этот третий компонент распределится между обоими слоями, образуя растворы различной концентрации и отношение концентраций в обоих слоях будет постоянным при данной температуре. Это положение называют законом распределения Нернста
19. Понятие о диаграммах состояния. Однокомп. Системы.
ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма), графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния т-ры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Для сложных систем, состоящих из многих фаз и компонентов, построение Д. с. является единственным методом, позволяющим на практике установить, сколько фаз и какие конкретно фазы образуют систему при данных значениях параметров состояния. Каждое реально существующее состояние системы на Д. с. изображается т. наз. фигуративной точкой; областям существования одной фазы отвечают участки пространства (на трехмерных Д. с.) или плоскости (на двухмерных Д. с.), условиям сосуществования фаз - соотв. пов-сти или линии; изменение фазового состояния системы рассматривается как движение фигуративной точки на Д. с. Анализ относит. расположения объемных участков, пов-стей, линий и точек, к-рые образуют Д. с., позволяет однозначно и наглядно определять условия фазового равновесия, появления в системе новых фаз и хим. соед., образования и распада жидких и твердых р-ров и т. п. Д. с. используют в материаловедении, металлургии, нефтепереработке, хим. технологии (в частности, при разработке методов разделения в-в), произ-вах электронной техники и микроэлектроники и т. п. С ее помощью определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы сплавов и т. п. Однокомпонентные системы. Однокомпонентной системой является любое простое в-во или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Д. с. обычно строят на плоскости в координатах Т-р (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р.
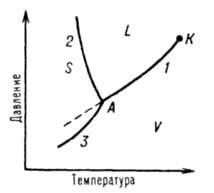
Диаграмма состояния однокомпонентной системы. S, L и V - соотв. области существования твердой, жидкой и паровой фаз; 1, 2 и 3 кривые кипения (испарения), плавления и возгонки (сублимации) соотв., К критич. точка; А тройная точка.
