
- •Импорт белка в эндоплазматический ретикулум.
- •2. Химический метод расщепления полипептидной цепи белка по остатку Met
- •3. Кросс-сшивающие реагенты, их классификация. Задачи, решаемые с помощью них
- •1. Пептидные антибиотики и пептиды-иммунорегуляторы
- •2. Химические методы расщепления полипептидной цепи белка по остаткам w, y
- •3. Фотоактивируемые кросс-сшивающие реагенты
- •1. Типы взаимодействий, определяющих пространственную структуру полипептидов. Элементы вторичной и третичной структур белка. Конфигурация пептидной связи. Углы φ, ω, ψ. Карты Рамачандрана.
- •2. Понятие о защите и активации α-nh2-группы. Специфическая модификация α- и ε-аминогрупп в белках: гуанидилирование, взаимодействие с иминоэфирами.
- •3. Посттрансляционная модификация белков с расщеплением полипептидного остова белка-предшественника
Билет 3
Импорт белка в эндоплазматический ретикулум.
Синтез основной массы белков протекает на полисомах в цитозоле. Особенность цитоплазматического синтеза белков заключается в том, что в зависимости от типа мРНК синтезируются различные белки, направляющиеся строго к своим внутриклеточным компонентам (связь мРНК-компартментализация). Это связано с тем, что разные по назначению белки имеют определенные сигнальные последовательности аминокислот, по которым разные молекулы распределяются в клетке.
В отличие от этих типов белков, белки экспортного назначения (пищеварительные ферменты, белки плазмы крови, гормоны и др.) и белки мембран (рецепторы) синтезируются на рибосомах, расположенных на мембранах эндоплазматического ретикулума и попадают внутрь вакуолей по мере синтеза полипептидной цепи, котрансляционно. Затем эти белки в составе или внутри вакуолей транспортируются по клетке.
За котрансляционный синтез растворимых внутривакуолярных белков и нерастворимых белков, входящих в состав мембран вакуолярной системы ответственен гранулярный эндоплазматический ретикулум (в народе называемый шероховатым). В нем же происходит первичная посттрансляционная модификация белков – их соединение с олигосахаридами (перв. гликозилирование). Дальнейшая судьба синтезированных продуктов определяется аппаратом Гольджи (вторичное гликозилирование, адресация по секреторному пути, по пути образования эндосом, экстрацеллюлярных рецепторов).
Гранулярным ЭПР был назван по наличию рибосом на мембране со стороны гиалоплазмы. Рибонуклеопротеиды расположены на мембране в виде полисом (множество рибосом, объединенных одной мРНК), имеющих вид плоских спиралей, розеток или гроздей. Это работающие, синтезирующие белок рибосомы, прикрепленные к мембранам своей большой субъединицей. Количество рибосом на ЭПР четко связано с его синтетической активностью. Так, на мембранах ЭПР в клетке несекретирующей молочной железы связывается до 25% клеточных рибосом, а после стимуляции лактации их кол-во там возрастает до 70%. Падение числа рибосом на мембранах ЭПР может происходить при дифференцировке клеток. Такое же уменьшение числа рибосом, связанных с ЭПР, наблюдается при различных патологических состояниях клеток.
Путь синтеза белков на рибосомах ЭПР таков: в гиалоплазме происходит связывание мРНК с рибосомой, начинается синтез полипептидной цепи, начинающийся с продукции сигнальной последовательности, богатой гидрофобными аминокислотами (16-30 остатков). Эта последовательность связывается с «узнающей сигнал частицей», находящейся в гиалоплазме (SRP-частица), состоящей из одной молекулы 7S РНК и 6 различных полипептидных цепей. Затем SRP-частица связывается с рибосомой, что приводит к полной остановке синтеза белка. На поверхности мембраны ЭПР, обращенной к гиалоплазме, расположены интегральные рецепторы, связывающиеся с SRP-частицами в комплексе с рибосомой. Такая «заякоренная» рибосома с SRP-частицей взаимодействует с большим белковым канальным комплексом – транслоконом. В результате связывания рибосомы с транслоконом происходит отделение SRP-частицы, и синтезированный первичный пептид входит в канал транслокона диаметром около 2 нм и продолжает синтезироваться. Сигнальная последовательность оказывается внутри ЭПР, где отщепляется с помощью сигнальной пептидазы. После окончания синтеза вся белковая молекула располагается в полости ЭПР, рибосома отделяется от транслокона и диссоциирует. Во время трансмембранного переноса растущей белковой цепи (т.е. котрансляционно) происходит её связь с олигосахаридами (гликозилирование): на белковую молекулу (на остатки аспарагина) переносится готовый блок олигосахаридов (2 молекулы N-ацетилглюкозамина, 9 молекул маннозы, 3 молекулы глюкозы), изначально связанный со специальным липидом на внутр. мембране ЭПР – долихолом. Перенос катализируется интегральным ферментом гликозилтрансферазой.
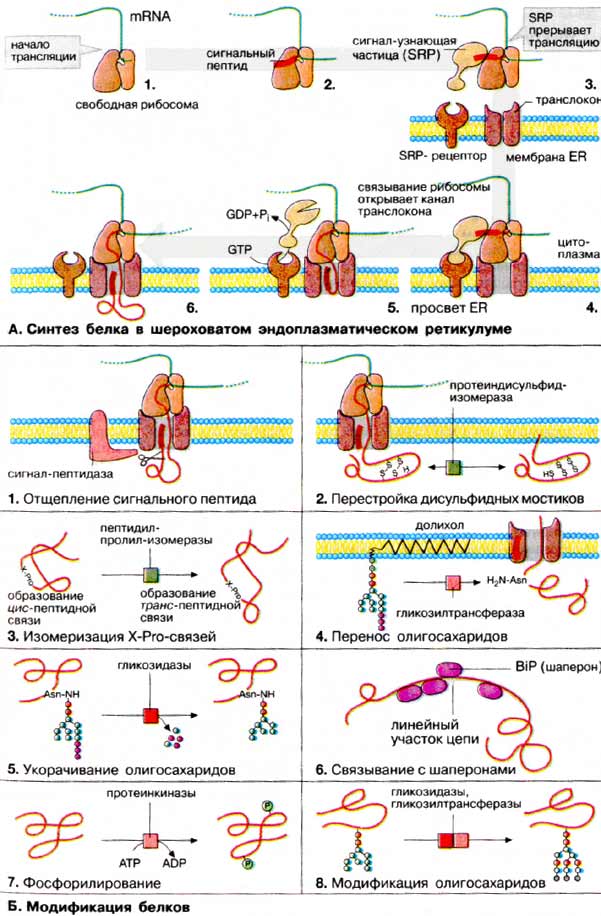
Попадая в полость цистерн ЭПР, белки претерпевают ряд дополнительных изменений: образуются дисульфидные связи, происходит правильное сворачивание и сборка четвертичной структуры белков.
