
- •Исторические сведения об открытии глюкагона
- •Биохимическая природа глюкагона
- •Биосинтез, хранение и секреция глюкагона
- •Транспорт глюкагона
- •Биохимические функции и молекулярный механизм действия глюкагона
- •Эндокринная патология, связанная с глюкагоном и лечение эндокринного расстройства
- •Заключение
- •Библиографический список
Транспорт глюкагона
Глюкагон вначале попадает в межклеточное пространство и интерстициальную жидкость, а затем с током крови через портальную вену — в печень, где он увеличивает гликогенолиз, снижает утилизацию глюкозы и синтез гликогена, повышает глюконеогенез и образование кетоновых тел. Суммарным эффектом этих воздействий является увеличение образования и выхода глюкозы из печени. В периферических тканях глюкагон оказывает липолитическое действие, повышая липолиз, снижая дипогенез и белковый синтез. Липолиз активируется гормон-чувствительной липазой.
Не исключено, что в организме транспорт глюкагона осуществляется в связанном с глобулинами состоянии. Этим, в частности, объясняются данные, показывающие, что полупериод исчезновения глюкагона плазмы крови составляет от 3 до 16 мин. Свободные формы глюкагона метаболизируют и удаляются из крови быстро, тогда как глюкагон, связанный с белками плазмы, метаболизируется более медленно. Концентрация глюкагона в портальной вене составляет от 300 до 4 500 пг/мл, тогда как в периферической крови — до 90 пг/мл (в среднем 24 ± 6 пг/мл) и в ответ на введение аргинина или холецистокинина увеличивается до 1 200 пг/мл. [6, C.203; 7, С.415].
Биохимические функции и молекулярный механизм действия глюкагона
Глюкагон оказывает свое специфическое действие через рецепторы. Установлено, что рецептор к глюкагону является гликопротеином, содержащим 4 N-связанные олигосахаридные цепи и внутримолекулярные дисульфидные мостики. Молекулярная масса рецептора составляет 62000. Глюкагонсвязывающие места располагаются на СООН-терминальном домене рецептора. Способность рецепторов к глюкагону взаимодействовать с соответствующим гормоном непостоянна и зависит от нескольких факторов. Связывание глюкагона с рецепторами уменьшается при гиперглюкагонемии, вызванной длительным голоданием, инсулиновой недостаточностью или экзогенным введением глюкагона. Однако несмотря на такую обратную регуляцию, процесс активирования аденилатциклазы под влиянием глюкагона не изменяется. Это состояние достигается тем, что оставшиеся рецепторы приобретают повышенную способность к комплексированию с гормоном.
Основное гликогенолитическое действие глюкагона осуществляется в печени, где он связывается с рецепторами гепатоцитов и активирует аденилатциклазу, которая переводит АТФ в цАМФ. Далее активизируется цАМФ-зависимая протеинкиназа, стимулирующая фосфорилазу киназы. Последняя конвертирует неактивную фосфорилазу в активную ее форму (фосфорилазу А), под влиянием которой ускоряются гликогенолиз и глюконеогенез, что сопровождается повышением образования глюкозы печенью. Наряду с этим протеинкиназа инактивирует гликогенсинтазу, вследствие чего замедляется синтез гликогена. Действие глюкагона на активность фосфорилазы и гликогенсинтазы развивается в течение 1-2 мин после введения гормона. Установлено также, что взаимодействие глюкагона с рецептором и активирование пострецепторных механизмов его действия протекают с обязательным участием ГТФ, дивалентных катионов (кальций и магний) и аденозина. После связывания глюкагона с рецептором мембраны происходят "погружение" глюкагонорецепторного комплекса в липидные слои мембраны и взаимодействие с гуаниннуклеотидсвязывающим белком. В результате этого белок освобождается от связи с гуанозиндифосфатом (ГДФ) и соединяется с гуанозинтрифосфатом (ГТФ). ГТФ-связанный белок после этого взаимодействует с каталитической субъединицей аденилатциклазы с образованием активного комплекса, переводящего АТФ в цАМФ с участием цАМФ-зависимой протеинкиназы. Таким образом, эффекты действия глюкагона опосредуются в основном цАМФ. Однако не исключается, что его гликогенолитическое влияние может осуществляться и другими (не цАМФ) механизмами. Секреция глюкагона, так же как и инсулина, осуществляется пульсирующим образом. [7, C.549-553].
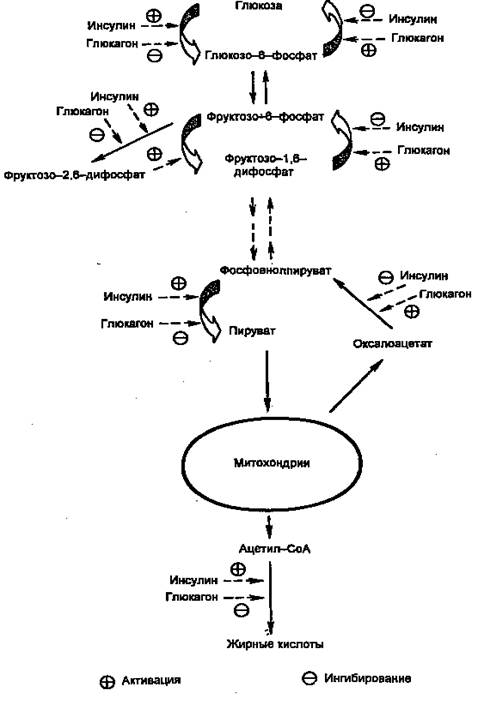 Г
Г
Рис.2 Действие инсулина и глюкагона на метаболизм глюкозы в печени
люкагон стимулирует кетогенез в печени, скорость которого зависит от поступления свободных жирных кислот в печень. Скорость кетогенеза печени определяется соотношением глюкагон/инсулин в крови, поступающей в печень. высокое соотношение глюкагон/инсулин повышает внутриклеточный уровень цАМФ, уменьшает гликогенолиз и активность ацетил-СоА карбоксилазы. Это снижает внутриклеточное содержание малонил-СоА, что сопровождается в свою очередь почти полной блокадой синтеза жирных кислот, вызывает угнетение карнитинацилтрансферазы и последующую стимуляцию липолиза с избыточным образованием кетоновых тел (ацетоацетата и 3-гидроксимасляной кислоты).Глюкагон в организме выполняет в первую очередь функцию обеспечения источниками энергии, защищая, таким
образом, организм от гипогликемии. Эту функцию он осуществляет путем влияния на углеводный, белковый и жировой обмен. В печени он стимулирует образование глюкозы как из гликогена (гликогенолиз), так и из аминокислот (глюконеогенез), что сопровождается увеличением продукции глюкозы печенью(Рис.2). Увеличивая липолиз жира, он способствует увеличению поступления СЖК в печень и повышению образования кетоновых тел. Среди всех контринсулиновых гормонов глюкагону принадлежит первое место. Помимо защитной функции от возможной гипогликемии, глюкагон также восстанавливает нормогликемию при уже развившейся гипогликемии.
Помимо поддержания энергетического гомеостаза, глюкагон умеренно снижает уровень холестерина и триглицеридов в сыворотке крови, а также стимулирует высвобождение инсулина. Вместе с инсулином он участвует в процессах регенерации печени. [8].
