
- •Исторические сведения об открытии глюкагона
- •Биохимическая природа глюкагона
- •Биосинтез, хранение и секреция глюкагона
- •Транспорт глюкагона
- •Биохимические функции и молекулярный механизм действия глюкагона
- •Эндокринная патология, связанная с глюкагоном и лечение эндокринного расстройства
- •Заключение
- •Библиографический список
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Московская государственная академия ветеринарной медицины и биотехнологии имени К. И Скрябина»
Кафедра химии имени профессоров С.И.Афонского, А.Г.Малахова
Реферат
На тему: «Глюкагон»
Выполнила: студентка 1 группы
4 курса ВБФ Акинина О.Ю
Проверила: доцент кафедры, к.б.н
Зарудная Е.Н
Москва, 2013 г.
Содержание
Введение 3
1.Исторические сведения об открытии глюкагона 4
2.Биохимическая природа глюкагона 5
3.Биосинтез, хранение и секреция глюкагона 7
4.Транспорт глюкагона 9
5.Биохимические функции и молекулярный механизм действия глюкагона 10
7.Эндокринная патология, связанная с глюкагоном и лечение эндокринного расстройства 12
Заключение 15
Библиографический список 16
Введение
Глюкагон (Glucagon; гр. glykys сладкий + gonos рождение) - белково-пептидный гормон поджелудочной железы, физиологический антагонист инсулина.
Когда присутствие гормона подтверждается только его аффектом, то его во многих случаях и называют по этому эффекту. Новый гормон из этих соображений был назван гипергликемическим гликогенолитическим фактором, что в переводе с греческого означает «повышающий содержание глюкозы в крови и расщепляющий гликоген». Так как биохимики тоже люди и не любят длинных слов, то вновь открытый фактор стали называть ГГФ, а недавно придумали более короткое наименование - глюкагон, которое и стало общеупотребительным. [1, С.84].
Исторические сведения об открытии глюкагона
Еще в 1923 г. F. Banting и С. Best при введении экстрактов поджелудочной железы экспериментальным животным отметили кратковременную преходящую гипергликемию, предшествующую гипогликемическому действию препарата. Они считали, что это влияние обусловлено веществом, образующимся в процессе приготовления препарата. Однако было установлено, что гипергликемия обусловлена особым веществом, которое Р. Kimball и Т. Murlin назвали глюкагоном. S. H. Staub в 1953 г. получил кристаллическую форму глюкагона, W. W. Bromer определил последовательность аминокислотных остатков в молекуле глюкагона свиньи. В последующем была установлена последовательность аминокислот в молекуле глюкагона быка и человека. [ 2, С.271].
Биохимическая природа глюкагона
Глюкагон представляет собой полипептидную цепь, состоящую из 29 аминокислотных остатков, в которой М-концевой аминокислотой является гистидин, а С-концевой — треонин. Последовательность аминокислотных остатков в молекуле глюкагона следующая: NH2-Гис-Сер-Гли-Гли-Тре-Фен-Тре-Сер-Асп-Тир-Сер-Лиз-Тир-Лей-Асп-Сер-Арг-Арг-Ала-Гли-Асп-Фен-Вал-Глн-Три-Лей-Мет-Асн-Тре-СООН.(Рис.1)
Первичная структура глюкагона человека и животных оказалась идентичной; исключение составляет только глюкагон индюка, у которого вместо аспарагина в положении 28 содержится серин. Особенностью структуры глюкагона является отсутствие дисульфидных связей и цистеина. Глюкагон образуется из своего предшественника проглюкагона, содержащего на С-конце полипептида дополнительный октапептид (8 остатков), отщепляемый в процессе постсинтетического протеолиза. Имеются данные, что у проглюкагона, так же как и у проинсулина, существует предшественник – препроглюкагон (мол. масса 9000), структура которого пока не расшифрована. [2, С.271].
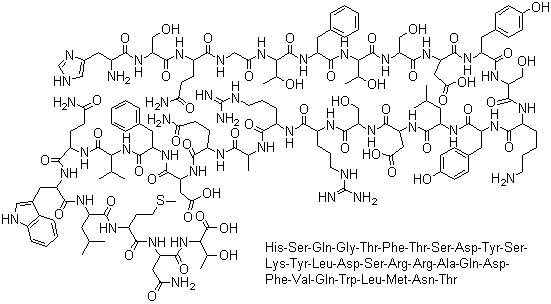
Рис.1 Строение глюкагона
Недавно проведенные исследования взаимоотношений между структурой и активностью показали, что остатки, расположенные на аминоконце молекулы, необходимы для связывания и клеточного действия гормона. Однако высокое сродство к своему рецептору, позволяющее гормону действовать в физиологических концентрациях, придает глюкагону карбоксильный конец молекулы. В отличие от инсулина глюкагон сохраняет одну и ту же аминокислотную последовательность у всех изученных видов млекопитающих. Молекулярная .масса глюкагона – 3485. [3, С.82].
В кристаллической форме глюкагон является тримером с большим содержанием вторичной структуры. Некоторые физические свойства глюкагона, такие как низкая растворимость при нейтральном значении рН и способность к образованию фибрилл в кислой среде, обусловлены его вторичной и третичной структурами. В концентрированных растворах состояние глюкагона определяется в основном α-спиралью его молекулы, тогда как в относительно разведенных растворах легко определяется вторичная структура. Центральная часть α-спирали проходит через 10-25-й аминокислотные остатки, которые располагаются в α-спирали, а аминокислотные остатки 5-9-й и 26-29-й определяют конформацию молекулы. Тетрамерная структура стабилизирована гидрофобными связями между участками спирали, в которой аминокислотные остатки в положениях 6, 10 и 13 (фенилаланин, тирозин и тирозин соответственно) ассоциированы с аминокислотными остатками в положении 22, 25 и 26 (фенилаланин, триптофан и лейцин соответственно). N-концевой участок менее подвижен, чем и объясняется почти полное отсутствие конформационных изменений в этом участке молекулы. Считается, что N-концевая и центральная молекулы ответственны за связывание глюкагона с периферическими рецепторами клеточных мембран и активирование аденилатциклазы. Предполагается, что конформационные изменения молекулы играют важную роль в распознавании соответствующего рецептора. Имеются данные, согласно которым липолитические свойства глюкагона обусловлены участком полипептидной цепи молекулы, включающим 19-23-й, а гликогенолитические — 24-29-й аминокислотные остатки.[4; 9]
