
- •И. А. Кировская
- •Получение, очистка и коагуляция коллоидных растворов
- •Дисперсные системы. Коллоидное состояние
- •Классификация дисперсных систем по агрегатному состоянию
- •1.2. Получение коллоидных растворов
- •Методы диспергирования
- •Методы конденсации
- •1.3. Очистка коллоидных растворов
- •1.4. Устойчивость и коагуляция коллоидных растворов Устойчивость коллоидных растворов. Виды устойчивости
- •Факторы устойчивости коллоидных растворов
- •Коагуляция коллоидных растворов
- •Факторы и стадии коагуляции
- •Коагуляция под действием электролитов
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •2.1. Броуновское движение
- •2.2. Диффузия
- •2.3. Осмотическое давление
- •2.4. Седиментационное равновесие
- •2.5. Седиментационный анализ
- •Принцип седиментационного анализа
- •Методы седиментационного анализа
- •Седиментация монодисперсных суспензий
- •Седиментация полимерных суспензий
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •3.1. Рассеяние света
- •3.2. Поглощение света
- •3.3. Оптическая анизотропия
- •Применение уравнения Рэлея. Нефелометрия. Турбидиметрия. Ультрамикроскопия
- •Нефелометрия
- •Турбидиметрия
- •Ультрамикроскопия
- •3.5. Электронная микроскопия
- •3.6. Другие практически важные следствия, вытекающие из анализа уравнения Рэлея
- •3.7. Оптические явления и окраска золей
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.1. Общая характеристика поверхностных явлений. Поверхностное натяжение
- •Адсорбция – самопроизвольный и экзотермический процесс
- •Тестовые задания
- •4.2. Адсорбция на границе раздела 11 жидкость - газ Термодинамический подход к рассмотрению адсорбции на границе раздела жидкость-газ
- •Построение изотермы адсорбции на границе раздела жидкость-газ графическим методом и определение характеристик поверхностного слоя
- •Построение изотермы адсорбции с помощью уравнения Шишковского и определение характеристик поверхностного слоя
- •Построение изотермы состояния мономолекулярного адсорбционного слоя
- •Влияние строения и размера молекулы поверхностно-активного вещества на адсорбцию на границе раздела жидкость - газ. Правило Дюкло-Траубе
- •Строение адсорбционного слоя на границе раздела жидкость – газ
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.3. Адсорбция на границе раздела твердое тело - газ Физическая и химическая адсорбция
- •Адсорбции
- •Равновесные (статические) изотермы адсорбции. Основные уравнения
- •Уравнения кинетических изотерм адсорбции
- •Основные термодинамические характеристики адсорбции Теплота адсорбции
- •Разновидности теплот адсорбции
- •Зависимость теплоты адсорбции от заполнения поверхности
- •Энтропия адсорбции
- •Способы определения энтропии адсорбции
- •Теоретический (статистический) расчет энтропии адсорбции
- •Кинетика адсорбции и десорбции Факторы, определяющие скорость адсорбции и десорбции
- •Энергетические соотношения при адсорбции. Способы определения энергии активации адсорбции. Зависимость ее от заполнения поверхности
- •Энергия активации десорбции
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.4. Адсорбция на границе раздела твердое тело - жидкость Общая характеристика адсорбции на границе раздела твердое тело - жидкость. Зависимость ее от различных факторов
- •Молекулярная адсорбция
- •Основные закономерности молекулярной адсорбции из разбавленных растворов
- •Адсорбция из растворов электролитов. Адсорбция ионов
- •Обменная адсорбция
- •Измерение адсорбции из растворов
- •4.5. Значение и практическое применение адсорбции
- •Понизители твердости для различных пород
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •5.1. Электрокинетические явления Прямые и обратные электрокинетические явления
- •Значение и практическое применение электрокинетических явлений Научное значение
- •Технические применения
- •5.2. Двойной электрический слой Развитие представлений о двойном электрическом слое
- •Механизмы возникновения двойного электрического слоя
- •Электрокинетический потенциал
- •Наиболее характерные свойства электрокинетического потенциала
- •Строение коллоидных частиц лиофобных золей (мицеллярная теория строения лиофобных золей)
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Библиографический список
- •Оглавление
- •Глава I. Дисперсные системы, коллоидное состояние.
- •Глава II. Молекулярно-кинетические свойства
- •Глава IV. Поверхностные явления……………………………………….. 71
- •ГлаваV. Электрические свойства коллоидных растворов.. …….. 155
Коагуляция под действием электролитов
Порог коагуляции. Для начала явной коагуляции в присутствии электролита необходимо, чтобы его концентрация превысила некоторую минимальную (критическую) величину – порог коагуляции ( или Ск).
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают Vк(Vк= 1/Ск). Последняя выражает число объемов золя, скоагулированного одним молем иона-коагулятора.
Следует иметь в виду, что величина порога коагуляции зависит от ряда условий: момента его фиксирования после внесения электролита, метода наблюдения, концентрации исследуемого золя и др., которые необходимо указывать.
Основные закономерности коагуляии. Коагулирующей частью электролита является тот ион, который несет заряд, противоположный по знаку заряду коллоидной частицы, т.е. для положительных золей коагуляторами являются анионы, а для отрицательных – катионы. Коагулирующая способность электролита сильно возрастает с валентностью иона-коагулятора: ионы высшей валентности имеют порог коагуляции значительно меньше, чем ионы меньшей валентности. Все эти закономерности, найденные Шульце и Гарди и подтвержденные многочисленными исследователями, известны как правило Щульце-Гарди.
Более строгую, теоретически обоснованную количественную связь между порогом быстрой коагуляции и валентностью иона-коагулятора выражает правило Дерягина-Ландау:
=
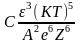 ,
(1.2)
,
(1.2)
где С - константа, слабо зависящая от соотношения валентностей катиона и аниона электролита; - диэлектрическая проницаемость раствора; КТ – энергия теплового движения одной частицы; А – постоянная Ван-дер-Ваальсовых сил притяжения; е –заряд электрона; Z – валентность противоиона.
Коагулирующее действие ионов одного и того же знака и одинаковой валентности также различно. Отмечено влияние размера и степени гидратации ионов (лиотропные ряды).
Коагулирующая способность органических ионов-коагуляторов значительно больше, чем неорганических.
В некоторой степени коагулирующая способность иона-коагулятора зависит от природы иона другого знака заряда, с ним связанного.
Процесс коагуляции осложняется, если применяют смесь электролитов. Наблюдаемые при этом явления можно свести к аддитивности, антагонизму и сенсибилизации электролитов.
Аддитивность заключается в суммировании коагулирующего действия электролитов. Примем порог коагуляции одного электролита равным С1, второго – С2. В случае аддитивного действия, если одного электролита прибавлено к золю С1/2, для начала коагуляции другого электролита надо прибавить С2/2. (Так, аддитивное действие наблюдается при коагуляции положительных золей смесью КС1 и KNO3, отрицательных золей - смесью NaCl и KCl).
Антагонизм3 заключается в понижении коагулирующего действия одного электролита при введении другого. (В качестве примера можно назвать пары электролитов KNO3-MgSO4, LiCl-MgCl2 и др.).
Сенсибилизация электролитов заключается в усилении коагулирующего действия одного электролита при прибавлении второго (примером может служить действие LiCl в присутствии CaCl2 на гидрозоль HgS).
Частным случаем коагуляции электролитами является взаимная коагуляция двух гидрофобных золей с различными знаками зарядов. В отличие от обычной электролитной коагуляции, когда перезарядка происходит только под действием многовалентных ионов-коагуляторов, при определенном соотношении концентраций смешиваемых золей всегда наступает перезарядка.
Современное объяснение устойчивости и коагуляции. В ходе развития представлений об устойчивости и механизмах коагуляции гидрофобных коллоидов растворами электролитов возникло много теорий, которые пытались объяснить три вопроса: 1) почему коагуляция наступает при определенной концентрации электролита - коагулятора; 2) почему при этом основную роль играет концентрация иона, несущего заряд, противоположный заряду частицы; 3) почему влияние заряда иона-коагулятора подчиняется закономерности, выраженной правилом Щульце-Гарди.
Многочисленные теории коагуляции в основном можно подразделить на адсорбционные и электростатические. Эти теории не объяснили всех экспериментальных фактов, но сыграли положительную роль в развитии науки об устойчивости коллоидных систем. Их важнейшие положения вошли составными частями в современную физическую теорию устойчивости коллоидных систем, развитую Дерягиным Б. В. и Ландау Л. Д. (1937), Фервеем Э. И. Овербеком Я. (1941) и известную как теория ДЛФО. Согласно этой теории между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкивания. Состояние системы (ее устойчивость) зависит от баланса энергии притяжения и энергии отталкивания частиц. Энергия притяжения обусловлена межмолекулярными силами, главным образом, силами Ван-дер-Ваальса. В первом приближении она обратно пропорциональна квадрату расстояния между частицами. Энергия отталкивания по теории ДЛФО, учитывающей только электростатическую составляющую расклинивающего давления (давления отталкивания), определяется электростатическим взаимодействием между ионами двойных электрических слоев, окружающих каждую частицу, и убывает с расстоянием по экспоненциальному закону.
Преобладание энергии отталкивания приводит к устойчивости системы, а преобладание энергии притяжения – к нарушению агрегативной устойчивости, т.е. коагуляции. Суммарная потенциальная энергия взаимодействия частиц отрицательна на близких и далеких расстояниях (преобладает энергия притяжения). Она может быть положительной на средних расстояниях (преобладает энергия отталкивания). Максимум потенциальной кривой (рис. 1.5) отвечает потенциальному барьеру G. Минимум 1 соответствует непосредственному соприкосновению частиц, а минимум II – притяжению частиц, между которыми имеются прослойки среды.
Скорость коагуляции. Медленная и быстрая коагуляция. Коагуляцию в зависимости от концентрации коагулирующего электролита можно подразделить на медленную и быструю. При медленной коагуляции изменение концентрации коагулирующего электролита сопровождается резким изменением скорости коагуляции. При быстрой коагуляции увеличение концентрации коагулирующего электролита не вызывает изменения скорости коагуляции, достигшей своего максимального значения. Концентрацию электролита, начиная с которой скорость коагуляции остается постоянной, называют порогом быстрой коагуляции. Ему отвечает полное исчезновение потенциального барьера Е. При сохранении небольшого потенциального барьера в системе протекает медленная коагуляция.
Кинетика быстрой коагуляции разработана М. Смолуховским, медленной - Н. Л. Фуксом.
Отношение констант скоростей быстрой и медленной коагуляций может служить мерой стабильности системы.

Рис. 1.5. Зависимость энергии взаимодействия U двух частиц от расстояния между ними h.
Типы электролитной коагуляции. Согласно теории ДЛФО, возможны основных механизма и соответственно два типа быстрой электролитной коагуляции:
1) концентрационная, при которой потеря устойчивости коллоидов вызывается сжатием диффузной части двойного электрического слоя при неизменяющемся -потенциале поверхности; 2) нейтрализационная, происходящая в результате снижения поверхностного -потенциала частиц.
Тип коагуляции зависит как от свойств коллоида, так и характера прибавляемых электролитов.
Концентрационная коагуляция обычно наблюдается в дисперсных системах с высоким потенциалом частиц при увеличении концентрации электролита, т. е. ионной силы раствора. Этот механизм коагуляции осуществляется при действии индифферентных электролитов, не способных к специфической адсорбции. Их добавление не изменяет величину -потенциала во внутренней обкладке двойного слоя. В таком случае коагуляцию вызывают электростатический эффект сжатия двойного электрического слоя и связанное с ним уменьшение -потенциала. Сжатие диффузного слоя является следствием перемещения части противоионов из диффузного слоя в адсорбционный слой (что ведет к дополнительной компенсации -потенциала) и подавления диффузии противоионов и уменьшения размытости диффузного слоя за счет увеличения ионной силы дисперсионной среды. Этот фактор является преобладающим для систем с сильно заряженными частицами.
Нейтрализационная (адсорбционная) коагуляция характерна для коллоидных систем, содержащих слабо заряженные частицы, и происходит в результате уменьшения -потенциала твердой поверхности. Этот тип коагуляции вызывают электролиты, имеющие ион, способный к специфической адсорбции на поверхности частиц и заряженный противоположно им. Способность к специфической адсорбции резко возрастает с увеличением заряда иона-коагулятора. Такие ионы, находясь в адсорбционном слое, нейтрализуют -потенциал и снижают его. Параллельно идет снижение -потенциала. Специфическая адсорбция ионов может привести к перезарядке поверхности частиц, поэтому нейтрализационная коагуляция ограничена определенными пределами концентрации электролита.
При концентрационной коагуляции порог коагуляции Ск в соответствии с правилом Дерягина-Ландау (обоснование эмпирического правила Щульце-Гарди) обратно пропорционален заряду противоинов в шестой степени, т.е.
 ,
(1.3)
,
(1.3)
При нейтрализационной коагуляции (при малых потенциалах поверхность
0 - частиц) показатель степени при Z в уравнении (3) уменьшается до двух (правило Эйлерса-Корфа).
Наиболее распространенные методы определения порога коагуляции заключаются в титровании золя раствором электролита до начала явной коагуляции или в наблюдениях за изменением светорассеяния (через определенное время после смешивания золя с электролитом).
