
- •И. А. Кировская
- •Получение, очистка и коагуляция коллоидных растворов
- •Дисперсные системы. Коллоидное состояние
- •Классификация дисперсных систем по агрегатному состоянию
- •1.2. Получение коллоидных растворов
- •Методы диспергирования
- •Методы конденсации
- •1.3. Очистка коллоидных растворов
- •1.4. Устойчивость и коагуляция коллоидных растворов Устойчивость коллоидных растворов. Виды устойчивости
- •Факторы устойчивости коллоидных растворов
- •Коагуляция коллоидных растворов
- •Факторы и стадии коагуляции
- •Коагуляция под действием электролитов
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •2.1. Броуновское движение
- •2.2. Диффузия
- •2.3. Осмотическое давление
- •2.4. Седиментационное равновесие
- •2.5. Седиментационный анализ
- •Принцип седиментационного анализа
- •Методы седиментационного анализа
- •Седиментация монодисперсных суспензий
- •Седиментация полимерных суспензий
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •3.1. Рассеяние света
- •3.2. Поглощение света
- •3.3. Оптическая анизотропия
- •Применение уравнения Рэлея. Нефелометрия. Турбидиметрия. Ультрамикроскопия
- •Нефелометрия
- •Турбидиметрия
- •Ультрамикроскопия
- •3.5. Электронная микроскопия
- •3.6. Другие практически важные следствия, вытекающие из анализа уравнения Рэлея
- •3.7. Оптические явления и окраска золей
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.1. Общая характеристика поверхностных явлений. Поверхностное натяжение
- •Адсорбция – самопроизвольный и экзотермический процесс
- •Тестовые задания
- •4.2. Адсорбция на границе раздела 11 жидкость - газ Термодинамический подход к рассмотрению адсорбции на границе раздела жидкость-газ
- •Построение изотермы адсорбции на границе раздела жидкость-газ графическим методом и определение характеристик поверхностного слоя
- •Построение изотермы адсорбции с помощью уравнения Шишковского и определение характеристик поверхностного слоя
- •Построение изотермы состояния мономолекулярного адсорбционного слоя
- •Влияние строения и размера молекулы поверхностно-активного вещества на адсорбцию на границе раздела жидкость - газ. Правило Дюкло-Траубе
- •Строение адсорбционного слоя на границе раздела жидкость – газ
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.3. Адсорбция на границе раздела твердое тело - газ Физическая и химическая адсорбция
- •Адсорбции
- •Равновесные (статические) изотермы адсорбции. Основные уравнения
- •Уравнения кинетических изотерм адсорбции
- •Основные термодинамические характеристики адсорбции Теплота адсорбции
- •Разновидности теплот адсорбции
- •Зависимость теплоты адсорбции от заполнения поверхности
- •Энтропия адсорбции
- •Способы определения энтропии адсорбции
- •Теоретический (статистический) расчет энтропии адсорбции
- •Кинетика адсорбции и десорбции Факторы, определяющие скорость адсорбции и десорбции
- •Энергетические соотношения при адсорбции. Способы определения энергии активации адсорбции. Зависимость ее от заполнения поверхности
- •Энергия активации десорбции
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.4. Адсорбция на границе раздела твердое тело - жидкость Общая характеристика адсорбции на границе раздела твердое тело - жидкость. Зависимость ее от различных факторов
- •Молекулярная адсорбция
- •Основные закономерности молекулярной адсорбции из разбавленных растворов
- •Адсорбция из растворов электролитов. Адсорбция ионов
- •Обменная адсорбция
- •Измерение адсорбции из растворов
- •4.5. Значение и практическое применение адсорбции
- •Понизители твердости для различных пород
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •5.1. Электрокинетические явления Прямые и обратные электрокинетические явления
- •Значение и практическое применение электрокинетических явлений Научное значение
- •Технические применения
- •5.2. Двойной электрический слой Развитие представлений о двойном электрическом слое
- •Механизмы возникновения двойного электрического слоя
- •Электрокинетический потенциал
- •Наиболее характерные свойства электрокинетического потенциала
- •Строение коллоидных частиц лиофобных золей (мицеллярная теория строения лиофобных золей)
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Библиографический список
- •Оглавление
- •Глава I. Дисперсные системы, коллоидное состояние.
- •Глава II. Молекулярно-кинетические свойства
- •Глава IV. Поверхностные явления……………………………………….. 71
- •ГлаваV. Электрические свойства коллоидных растворов.. …….. 155
Теоретический (статистический) расчет энтропии адсорбции
Теоретический расчет энтропии адсорбции проводится для идеальных подвижных монослоев с помощью известных формул статистической термодинамики для сумм состояния, включающих двухмерные поступательные, вращательные и колебательные степени свободы молекул.
В общем случае нелинейных молекул функция состояния для трехмерного измерения
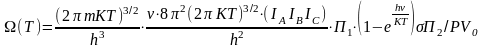 ,
(4.53)
,
(4.53)
где IA, IB, IC - моменты инерции; - число симметрии, равное числу неразличимых конфигураций вращения молекулы, рассматриваемой как твердое тело; произведение П1 взято по всем нормальным колебаниям; V0 - статистический вес низшего электронного уровня; П2 - произведение спиновых весов всех ядер в молекуле. В этой формуле пренебрегаются внутренние вращения молекулы. Кембол [10] применил подобное, но несколько упрощенное выражение для расчета энтропии адсорбции.
Используемые при этом модели всегда имеют два предельных случая. В модели локализованной адсорбции предполагается, что атомы прочно связаны с адсорбционными центрами и не обладают ни поступательными степенями свободы, ни колебаниями, параллельными или перпендикулярными поверхности. В этом случае энтропия адсорбционного слоя соответствует энтропии системы п частиц, распределенных по n0 центрам (так называемой энтропии локализации):
S
лок
= -
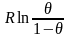 . (4.54)
. (4.54)
Ко второму предельному случаю относится модель, отвечающая двухмерному идеальному поверхностному газу, в котором сохраняются внутренние вращательные степени свободы, а также существует возможность случайных перемещений адсорбированной частицы в направлении, перпендикулярном поверхности.
Естественно, можно представить себе много промежуточных ситуаций и поэтому бывает трудно решить, какие же из степеней свободы действительно вносят вклад в суммарную энтропию адсорбционного слоя. Тем не менее, обобщая такие ситуации в поведении адсорбированных частиц, можно выделить следующие варианты теоретического расчета энтропии адсорбции [11,12]
1. а) поступательная энтропия идеального газа с молекулярной массой М при
Р =1 атм (133,3 760 Па) в трехмерном пространстве
3Sпост = Rln M3/2T5/2 - 2,30; (4.55)
б) поступательная энтропия идеального газа в двухмерном пространстве
(состоянии)
2Sпост = R ln MTS +65,8. (4.56)
2. Адсорбция локализованная. Ей присущи конфигурационные энтропии Sконф., обусловленные различными способами распределения молекул по поверхности:
а) для случая адсорбции на одиночном центре
Sконф.=
Kln
= R
 . (4.57)
. (4.57)
Логарифм определяется по формуле Стирлинга. Дифференциальная молярная величина конфигурационной энтропии определяется дифференцированием (57) по числу адсорбированных молекул:
 .
(4.58)
.
(4.58)
Обозначив
=
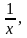 получим
получим
Sконф. = R[(x ln – 1) ln(x-1)] ; (4.59)
б) если адсорбция сопровождается диссоциацией молекул на две частицы и каждый поверхностный центр окружен четырьмя соседними, то
Sконф.
=
 (4.60)
(4.60)
в) если каждый поверхностный центр окружен шестью соседними частицами, то
S
конф.
=R (4.61)
(4.61)
3. Степень свободы поступательного движения, перпендикулярного к поверхности, теряющаяся при адсорбции, заменяется степенью свободы колебательного движения .
Sкол.
= R . (4.62)
. (4.62)
4. Принимаются во внимание вращательные степени свободы:
Sвращ.=R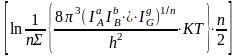 (4.63)
(4.63)
(а + b + ...g = n; IA, IB ...IG - моменты инерции, - число симметрии).
Таким образом, в общем случае энтропию адсорбированных молекул можно представить в виде суммы двух членов:
S = Sтр + S конф., (4.64)
где Sтр включает в себя все степени свободы движения молекулы; Sконф. учитывает число способов размещения nА молекул по n0 адсорбционным центрам.
