
- •И. А. Кировская
- •Получение, очистка и коагуляция коллоидных растворов
- •Дисперсные системы. Коллоидное состояние
- •Классификация дисперсных систем по агрегатному состоянию
- •1.2. Получение коллоидных растворов
- •Методы диспергирования
- •Методы конденсации
- •1.3. Очистка коллоидных растворов
- •1.4. Устойчивость и коагуляция коллоидных растворов Устойчивость коллоидных растворов. Виды устойчивости
- •Факторы устойчивости коллоидных растворов
- •Коагуляция коллоидных растворов
- •Факторы и стадии коагуляции
- •Коагуляция под действием электролитов
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •2.1. Броуновское движение
- •2.2. Диффузия
- •2.3. Осмотическое давление
- •2.4. Седиментационное равновесие
- •2.5. Седиментационный анализ
- •Принцип седиментационного анализа
- •Методы седиментационного анализа
- •Седиментация монодисперсных суспензий
- •Седиментация полимерных суспензий
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •3.1. Рассеяние света
- •3.2. Поглощение света
- •3.3. Оптическая анизотропия
- •Применение уравнения Рэлея. Нефелометрия. Турбидиметрия. Ультрамикроскопия
- •Нефелометрия
- •Турбидиметрия
- •Ультрамикроскопия
- •3.5. Электронная микроскопия
- •3.6. Другие практически важные следствия, вытекающие из анализа уравнения Рэлея
- •3.7. Оптические явления и окраска золей
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.1. Общая характеристика поверхностных явлений. Поверхностное натяжение
- •Адсорбция – самопроизвольный и экзотермический процесс
- •Тестовые задания
- •4.2. Адсорбция на границе раздела 11 жидкость - газ Термодинамический подход к рассмотрению адсорбции на границе раздела жидкость-газ
- •Построение изотермы адсорбции на границе раздела жидкость-газ графическим методом и определение характеристик поверхностного слоя
- •Построение изотермы адсорбции с помощью уравнения Шишковского и определение характеристик поверхностного слоя
- •Построение изотермы состояния мономолекулярного адсорбционного слоя
- •Влияние строения и размера молекулы поверхностно-активного вещества на адсорбцию на границе раздела жидкость - газ. Правило Дюкло-Траубе
- •Строение адсорбционного слоя на границе раздела жидкость – газ
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.3. Адсорбция на границе раздела твердое тело - газ Физическая и химическая адсорбция
- •Адсорбции
- •Равновесные (статические) изотермы адсорбции. Основные уравнения
- •Уравнения кинетических изотерм адсорбции
- •Основные термодинамические характеристики адсорбции Теплота адсорбции
- •Разновидности теплот адсорбции
- •Зависимость теплоты адсорбции от заполнения поверхности
- •Энтропия адсорбции
- •Способы определения энтропии адсорбции
- •Теоретический (статистический) расчет энтропии адсорбции
- •Кинетика адсорбции и десорбции Факторы, определяющие скорость адсорбции и десорбции
- •Энергетические соотношения при адсорбции. Способы определения энергии активации адсорбции. Зависимость ее от заполнения поверхности
- •Энергия активации десорбции
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •4.4. Адсорбция на границе раздела твердое тело - жидкость Общая характеристика адсорбции на границе раздела твердое тело - жидкость. Зависимость ее от различных факторов
- •Молекулярная адсорбция
- •Основные закономерности молекулярной адсорбции из разбавленных растворов
- •Адсорбция из растворов электролитов. Адсорбция ионов
- •Обменная адсорбция
- •Измерение адсорбции из растворов
- •4.5. Значение и практическое применение адсорбции
- •Понизители твердости для различных пород
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •5.1. Электрокинетические явления Прямые и обратные электрокинетические явления
- •Значение и практическое применение электрокинетических явлений Научное значение
- •Технические применения
- •5.2. Двойной электрический слой Развитие представлений о двойном электрическом слое
- •Механизмы возникновения двойного электрического слоя
- •Электрокинетический потенциал
- •Наиболее характерные свойства электрокинетического потенциала
- •Строение коллоидных частиц лиофобных золей (мицеллярная теория строения лиофобных золей)
- •Тестовые задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Библиографический список
- •Оглавление
- •Глава I. Дисперсные системы, коллоидное состояние.
- •Глава II. Молекулярно-кинетические свойства
- •Глава IV. Поверхностные явления……………………………………….. 71
- •ГлаваV. Электрические свойства коллоидных растворов.. …….. 155
Равновесные (статические) изотермы адсорбции. Основные уравнения
К настоящему времени удалось получить изотермы адсорбции в широком интервале давлений, начиная от Р 0,01 Рs и кончая давлением насыщенного пара на различных по своей природе адсорбентах. Анализ накопленного экспериментального материала позволил Брунауэру, Демингу, Теллеру выделить пять основных типов изотерм (рис. 4.10). Первая изотерма отображает мономолекулярную, четыре остальных - моно- и полимолекулярную адсорбцию: 1 – кривая Лэнгмюровского типа, II - s-образная кривая с линейным участком в области средних Р, III - вогнутая кривая без перегибов с монотонным ростом d/dP, IV, V - кривые типов II, III, осложненные капиллярной конденсацией, сопровождающей полимолекулярную адсорбцию.

а б
Рис. 4.9. Температурная зависимость адсорбции СО (а) на порошках GaAs (I), ZnSe (2), CuBr (3) при Ро= 100-103,7 Па; пленках ZnTe (4), CdSe (5), CdTe (6) при Ро= 4,1- 6,38 Па и Н2О (б) на порошках GaAs (I), ZnSe (2) при Ро= 40 - 42,6 Па; InSb (3) при Ро= 4,7 Па
Такая классификация охватывает подавляющее большинство описанных в литературе изотерм. Однако есть изотермы, которые не относятся ни к одному из указанных типов. Например, получены изотермы с изломом в области мономолекулярной адсорбции, соответствующим, по всей вероятности, фазовому переходу адсорбированного вещества. В некоторых случаях обнаружено несколько таких изломов, которые не находят объяснения в рамках классических теорий.
Рассмотрим изотерму I, как наиболее распространенную для мономолекулярной адсорбции. По характеру зависимости величины адсорбции от давления на ней можно выделить три области: 1 - низких, 2 - средних и 3 - высоких давлений. В области 1 соотношение между давлениями и величиной адсорбции выражается прямой пропорциональностью - уравнением Генри:
= КP. (4.24)
К нему можно подойти, рассматривая процесс адсорбции из газовой фазы с динамической точки зрения.
2-я область изотермы, отвечающая средним давлениям и напоминающая по своему виду параболу, удовлетворительно описывается эмпирическим уравнением Фрейндлиха - Бедекера:
а
= x/m
= КP (4.25)
(4.25)
или = a / s = КP , (4.26)
где m - масса адсорбента; Р - равновесное давление газа над адсорбентом,
s
- удельная поверхность; К
и
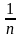 - константы. Для адсорбции из раствора
уравнение Фрейндлиха - Бедекера
- принимает
следующий вид:
- константы. Для адсорбции из раствора
уравнение Фрейндлиха - Бедекера
- принимает
следующий вид:
а
= x /m = (4.27)
(4.27)
где С - равновесная концентрация, - константа. Данное уравнение, представляя собой уравнение параболы, не может дать прямолинейного нарастания адсорбции с давлением или концентрацией (область 1) и предельного значения адсорбции (область 3).
В целом адсорбционная изотерма I удовлетворительно описывается уравнением
Лэнгмюра
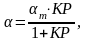 (4.28)
(4.28)
где
m
— емкость
монослоя, т. е. максимальное количество
газа, которое может быть адсорбировано
в виде монослоя на поверхности твердого
тела, К =
/ .
Дейcтвительно,
при очень малых Р КP
<< 1 и уравнение (4.11) переходит в
(4.24). В области высоких давлений КP
>>1, в результате уравнение (4.28)
принимает выражение
= m
и показывает, что количество
адсорбированного газа не изменяется
более с изменением давления.
.
Дейcтвительно,
при очень малых Р КP
<< 1 и уравнение (4.11) переходит в
(4.24). В области высоких давлений КP
>>1, в результате уравнение (4.28)
принимает выражение
= m
и показывает, что количество
адсорбированного газа не изменяется
более с изменением давления.
Для обработки экспериментальных данных уравнение Лэнгмюра удобнее выразить в виде
Р/ = 1 / К m +P/m . (4.29)
Откладывая Р/ от Р, получают прямую линию, из параметров которой находят m и К. К уравнению Лэнгмюра можно подойти, опираясь на термодинамическую, статистическую и кинетическую модели. Сам Лэнгмюр при выводе данного уравнения (1916 г.) использовал кинетическую модель [2]. Из этой же модели вытекает уравнение Генри как простейший вариант уравнения Лэнгмюра.
В ряде случаев статистические изотермы адсорбции описываются уравнением Шлыгина-Фрумкина-Темкина:
= C1 lnР + C2 , (4.30)
где С1 и С2-- константы, Р - равновесное давление. Оно было выведено теоретически на основе электрохимических исследований.
Наиболее универсальным уравнением, с помощью которого можно описать все виды изотерм, является уравнение БЭТ:
 (4.31)
(4.31)
где — величина адсорбции, отвечающая мономолекулярному покрытию, C = exp (E1-EL) / RT; E1 - теплота адсорбции в первом слое; EL - теплота конденсации; E1 - EL - чистая теплота адсорбции. Это уравнение было выведено Брунауэром, Эмметом и Теллером (1940 г.), исходя из теории полимолекулярной адсорбции и известного уравнения Лэнгмюра [2].
Если Е1 > ЕL, тогда С 1, и уравнение (4.31) приводит к кривым типа II и IV. При Е1 < ЕL получаем кривые типа III и V (рис. 4.10).

Рис. 4.10. Изотермы адсорбции

Рис. 4.11. Изопикны адсорбции Рис. 4.12. Изостеры адсорбции
Таким образом, форма кривой изотермы меняется в зависимости от соотношения Е1, и Е2, что и подтверждает универсальность данного уравнения. При малом значении Р/ Рs оно переходит в уравнение Лэнгмюра.
Уравнение БЭТ хорошо применимо ко многим адсорбентам в интервале Р/РS от 0,05 до 0,35 и обусловливает учет всех равноценных мест на поверхности адсорбента.
