
- •Физикалық және коллоидтық химия пәні және маңызы.
- •Физико – химиялық зерттеу әдістері.
- •Физикалық және коллоидтық химияның негізгі бөлімдері.
- •Молекула құрылысы. Полярлы және полярлы емес молекулалар.
- •Молекулалардың полярлануы. Дебай, Клаузис - Моссоти теңдеулері.
- •Лорентц - Лоренц теңдеуі. Молекулярлық рефракция.
- •§ 1.2 Молекулалардың рефракциясы
- •Термодинамиканың бірінші заңы
- •Гесс заңы
- •Жылу сыйымдылық
- •Жылу эффектісінің температурадан тәуелділігі (Кирхгоф заңдылығы)
- •Термодинамиканың екінші заңы
- •Әртүрлі процестердегі энтропия өзгерісі
- •Гиббс-Гельмгольц теңдеуі
- •Химиялық тепе-теңдік термодинамикасы Химиялық тепе-теңдік туралы түсінік
- •Химиялық реакцияның изотерма теңдеуі
- •Тепе-теңдік константасының температурадан тәуелділігі. Изобара және изохора теңдеулері.
- •Реакция реагенттер концентрацияларының тепе-теңдіке әсері
- •Фазалық тепе-теңдік Негізгі түсініктер мен анықтамалар
- •Гиббс фазалар ережесі. Клаузиус-Клапейрон теңдеуі.
- •Бір компонентті гетерогенді жүйелер
- •Екі компонентті жүйелердің диаграмма күйі
- •Конгруэнтті және инконгруэнтті балқымалы химиялық қосылыстары бар жүйелер
- •Үш компонентті жүйелер
- •Негізгі түсініктер мен анықтамалар
- •Ертінділер концентрацияларының бейнелену жолдары
- •Рауль заңы
- •Сұйытылған ерітінділердің қату температуралары
- •Сұйытылған ерітінділердің қайнау температурасы
- •Сұйытылған ерітінділердің осмостық қысымы
- •Электрохимия Электролит ерітінділері
- •Әлсіз және күшті электролиттер. Оствальдтың сұйылту заңы.
- •Электролит ерітінділерінің электр өткізгіштігі
- •Кольрауш заңы
- •Электрохимиялық тепе-теңдік
- •Нернст теңдеуі
- •Электродтар түрлері
- •Химиялық кинетика Реакцияның жылдамдығы және жылдамдық константасы
- •Химиялық реакциялардың реті мен молекулалығы
- •Реакция жылдамдығының температураға тәуелділігі
- •Дисперсті жүйелер
- •Дисперсті жүйелердің жіктелуі
- •А) Дисперстілігіне қарай жіктелуі
- •Б) Фазалардың агрегаттық жағыдайына байланысты жіктелуі
- •Аэрозольдердің практикада қолданылуы
- •В) Фаза аралық әрекеттесу бойынша жіктелуі
- •Беттік құбылыстар Беттік энергия және беттік керілу.
- •Беттік керілудің орта полярлығына тәуелділігі
- •Адсорбция
- •Мономолекулалы адсорбция теориясы
- •Адсорбенттер типтері
- •Порасыз адсорбенттер
- •Поралы адсорбенттер
- •Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері
- •Броун қозғалысы
- •Диффузия
- •Осмостық қысым
- •Седиментация
- •Коллоидты жүйелерді алу мен тазалау
- •Алу шарттары:
- •Коллоидты жүйелерді алудың конденсациялық әдістері
- •Физикалық конденсация
- •Химиялық конденсация
- •Диспергирлеу әдістерімен коллоидты жүйелерді алу
- •Дисперсті жүйелердің оптикалық қасиеттері Дисперсті жүйелердің оптикалық қасиеттерінің ерешеліктері
- •Жарықты шашырату
- •Жарықты сіңіру
- •Дисперстілікті талдаудың оптикалық әдістері
- •Коллоидты жүйелердің электрлік қасиетері Қос электрлік қабаттың түзілуі
- •Мицелла құрылысы
- •Электрокинетикалық құбылыстар
- •§ 5.5. Методы определения дзета - потенциала
- •§ 5.2. Теория дэс
- •Тестовые вопросы к теме: электрические свойства коллоидных систем и строение мицеллы
- •Коагуляция (ұю) және тұрақтандыру
- •Коллоидты беттік активті заттар Коллоидты баз түрлері
- •Коллоидты баз ерітінділерінің қасиеттері
Кольрауш заңы
Шексіз
үлкен сұйылтқанда (λ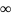 )
ерітіндінің электролиттің эквиваленттік
электрөткізгіштігі қозғалмалы катиондар
мен аниондардың қосындысына тең:
)
ерітіндінің электролиттің эквиваленттік
электрөткізгіштігі қозғалмалы катиондар
мен аниондардың қосындысына тең:
λ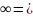 λk+
+ λa-
λk+
+ λa-
мұнда λk+ , λa- қозғалмалы катиондар мен аниондар.
Иондардың қозғалмалылығы олардың қозғалысының абсолюттік жылдамдығына пропорционал:
λk+ = vk+F, λa- = va- F
мұнда vk+, va- - катиондар мен аниондардың қозғалысының абсолюттік жылдамдығы.
F – Фарадей тұрақтысы (96500 Кл/моль).
Иондардың қозғалмалығы темпертурадан, еріткіштің табиғаты мен иондардың табиғатынан тәуелді.
Әлсіз электролиттер үшін диссоциациялану дәрежесі (α) келесі формула бойынша өрнектеледі:
α
=
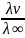
 –
шексіз
cұйылтқандағы эквиваленттік
электрөткізгіштік.
–
шексіз
cұйылтқандағы эквиваленттік
электрөткізгіштік.
Диссоциация
константасы Кдис,
α
және
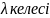 қатынастармен байланысты:
қатынастармен байланысты:

Ерітіндіні
сұйылтқанда V=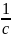 екенін ескеріп келісідей теңдеуді
аламыз:
екенін ескеріп келісідей теңдеуді
аламыз:

Электрохимиялық тепе-теңдік
Гальваникалық элементтер химиялық және концентрациялық болып бөлінеді. Химиялық гальваникалық элементтер дегеніміз химиялық реакциялар энергиясын электрлікке өзгертетін құрылғыны айтамыз. Мысал ретінде Якоби-Даниэль элементін алуға болады.
Мырыш электроды келесі реакция жүретін электрондардың шығу көзі болып табылады:
Zn0 = Zn2+ + 2e (тотығу)
Мыс электродта:
Cu2+ + 2e- → Cu0 (тотықсыздану)
Реакцияның қосындысы былай өрнектеледі:
Zn0 +Cu2+ → Zn2+ + Cu0
Химиялық гальваникалық элементтерді келесі сызбамен көрсетеді:
(-)М1│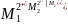
Үздіксіз сызықпен Қ-Қ және Қ-С фазалық беттерін бөледі, үзікті сызықпен – екі сұйықтың бөлім беттері бөлінген. Ерітіндіге салынған электрод ерітіндімен бірге жартылай элементтер деп аталады, оны келесі түрде бейнелейді:
М1│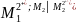 ;
Zn0
;
Zn0 ZnSO4;
Cu0
ZnSO4;
Cu0
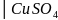
Оң жағында тотығу жүзеге асатын оң электрод.
Концентрациялық гальваникалық элементтер дегеніміз электр тогының шығу көзі болып электролиттің концентрліліктен сұйытылған ерітіндіге ауысу жұмысы болып табылатын элемент.
Мысал ретінде келесі элементті қарастыруға болады:
(-)Ag0│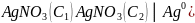 ˃
c2
˃
c2
Кез-келген элементтің электр қозғаушы күші (ЭҚК) жартылай элементтердің потенциалдар айырымына тең.
Тотықсыздану (оң электрод) болатын электрод потенциалынан тотығу (теріс электрод) болатын электрод потенциалын алып тастайды.
Е = Е1- Е2
Е1,Е2 – электродтық потенциалдар. Мысалы, Якоби-Даниэль элементі үшін:
Е
=

Нернст теңдеуі
Электродтық потенциал электродтың табиғатынан, температурадан, ерітіндідегі металл иондарының белсенділігінен, зат бөлшегінің валенттігінен тәуелді. Бұл тәуелділік Нернст теңдеумен өрнектеледі:
Е
=
Е0
+

Мұнда Е – электродтық потенциал;
Е0 - стандартты электродтық потенциал – бірге тең иондардың белсенділігі кезіндегі электродтардың потенциалы;
R – универсал газ тұрақтысы, 8,314 Дж/моль К;
Т – температура;
n – электрон заряды;
F – Фарадей тұрақтысы; 9,648 ∙104 кг/моль;
а – ерітіндідегі иондардың белсенділігі.
Сұйытылған ерітінділер үшін
Е
=
Е0
+
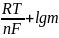
m – ерітіндінің молялдығы, моль/кг.
298 К (250С) температура үшін Нернст теңдеуі былай болады:
Е
=
Е0
+
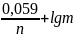
Тотығу-тотықсыздану электродтарының потенциалы берілген заттың тотыққан және тотықсызданған формаларының белсенділік қатынастарына тәуелді және келесі формуламен анықталады:
Е
=
Е0
+
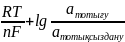
Мұнда атотығу – заттың тотыққан формасының белсенділігі;
атотықсыздану – заттың тотықсызданған формасының белсенділігі;
Е0 - тотығу-тотықсызданудың стандартты потенциалы.
Концентрациялық элементтер үшін:
Е
=
Е0
+

а1, а2 – әртүрлі концентрациясы бар иондардың белсенділігі.
Сол жақта жазылған оң мәні Е ˃ 0 гальваникалық элементтің электродында өздігінен тотығу жүреді, екіншісінде – заттың тотықсыздануы жүреді.
Мысалы, гальваникалық элемент үшін:
Pt│Sn2+, Sn4+ Fe3+, Fe2+│Pt
Е ˃ 0 мәні реакцияның өздігінен жүретінін көрсетеді
Sn2+ + 2 Fe3+ → Sn4+ + 2 Fe2+
Е ˂ 0 кезінде, гальваникалық элементте өздігінен өтетін реакция жүреді.
Sn4+ + 2 Fe2+ → Sn2+ + 2 Fe3+
Элементтің ЭҚК есептеп, теңдеу бойынша Гиббс энергия өзгерісін анықтауға болады:
∆G = -nFE
n – электрондық процесске қатысатын электрондар саны.
F – Фарадей тұрақтысы (96500 Кал/моль)
Егер
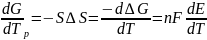
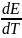 – ЭҚК
температуралық коэффициенті.
– ЭҚК
температуралық коэффициенті.
∆H = -nF E-T
∆Н – электродтық процесстің жылу эффектісі.
