
- •Физикалық және коллоидтық химия пәні және маңызы.
- •Физико – химиялық зерттеу әдістері.
- •Физикалық және коллоидтық химияның негізгі бөлімдері.
- •Молекула құрылысы. Полярлы және полярлы емес молекулалар.
- •Молекулалардың полярлануы. Дебай, Клаузис - Моссоти теңдеулері.
- •Лорентц - Лоренц теңдеуі. Молекулярлық рефракция.
- •§ 1.2 Молекулалардың рефракциясы
- •Термодинамиканың бірінші заңы
- •Гесс заңы
- •Жылу сыйымдылық
- •Жылу эффектісінің температурадан тәуелділігі (Кирхгоф заңдылығы)
- •Термодинамиканың екінші заңы
- •Әртүрлі процестердегі энтропия өзгерісі
- •Гиббс-Гельмгольц теңдеуі
- •Химиялық тепе-теңдік термодинамикасы Химиялық тепе-теңдік туралы түсінік
- •Химиялық реакцияның изотерма теңдеуі
- •Тепе-теңдік константасының температурадан тәуелділігі. Изобара және изохора теңдеулері.
- •Реакция реагенттер концентрацияларының тепе-теңдіке әсері
- •Фазалық тепе-теңдік Негізгі түсініктер мен анықтамалар
- •Гиббс фазалар ережесі. Клаузиус-Клапейрон теңдеуі.
- •Бір компонентті гетерогенді жүйелер
- •Екі компонентті жүйелердің диаграмма күйі
- •Конгруэнтті және инконгруэнтті балқымалы химиялық қосылыстары бар жүйелер
- •Үш компонентті жүйелер
- •Негізгі түсініктер мен анықтамалар
- •Ертінділер концентрацияларының бейнелену жолдары
- •Рауль заңы
- •Сұйытылған ерітінділердің қату температуралары
- •Сұйытылған ерітінділердің қайнау температурасы
- •Сұйытылған ерітінділердің осмостық қысымы
- •Электрохимия Электролит ерітінділері
- •Әлсіз және күшті электролиттер. Оствальдтың сұйылту заңы.
- •Электролит ерітінділерінің электр өткізгіштігі
- •Кольрауш заңы
- •Электрохимиялық тепе-теңдік
- •Нернст теңдеуі
- •Электродтар түрлері
- •Химиялық кинетика Реакцияның жылдамдығы және жылдамдық константасы
- •Химиялық реакциялардың реті мен молекулалығы
- •Реакция жылдамдығының температураға тәуелділігі
- •Дисперсті жүйелер
- •Дисперсті жүйелердің жіктелуі
- •А) Дисперстілігіне қарай жіктелуі
- •Б) Фазалардың агрегаттық жағыдайына байланысты жіктелуі
- •Аэрозольдердің практикада қолданылуы
- •В) Фаза аралық әрекеттесу бойынша жіктелуі
- •Беттік құбылыстар Беттік энергия және беттік керілу.
- •Беттік керілудің орта полярлығына тәуелділігі
- •Адсорбция
- •Мономолекулалы адсорбция теориясы
- •Адсорбенттер типтері
- •Порасыз адсорбенттер
- •Поралы адсорбенттер
- •Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері
- •Броун қозғалысы
- •Диффузия
- •Осмостық қысым
- •Седиментация
- •Коллоидты жүйелерді алу мен тазалау
- •Алу шарттары:
- •Коллоидты жүйелерді алудың конденсациялық әдістері
- •Физикалық конденсация
- •Химиялық конденсация
- •Диспергирлеу әдістерімен коллоидты жүйелерді алу
- •Дисперсті жүйелердің оптикалық қасиеттері Дисперсті жүйелердің оптикалық қасиеттерінің ерешеліктері
- •Жарықты шашырату
- •Жарықты сіңіру
- •Дисперстілікті талдаудың оптикалық әдістері
- •Коллоидты жүйелердің электрлік қасиетері Қос электрлік қабаттың түзілуі
- •Мицелла құрылысы
- •Электрокинетикалық құбылыстар
- •§ 5.5. Методы определения дзета - потенциала
- •§ 5.2. Теория дэс
- •Тестовые вопросы к теме: электрические свойства коллоидных систем и строение мицеллы
- •Коагуляция (ұю) және тұрақтандыру
- •Коллоидты беттік активті заттар Коллоидты баз түрлері
- •Коллоидты баз ерітінділерінің қасиеттері
Ертінділер концентрацияларының бейнелену жолдары
Проценттік концентрация (салмақ %) 100 г. (100 кг) ерітіндіде еріген заттың грамм (кг) санымен көрсетіледі.
Молярлық концентрация (молярлық) 1 л ерітіндіде еріген заттың моль санымен анықталады.
c=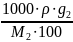
Нормалдық концентрация (нормалдылығы) 1 л ерітіндідегі еріген заттың эквиваленттік массасының санымен анықталады.
N=
Молялдық концентрация (молялдығы) 1000 г еріткіштегі еріген заттың санымен анықталады.
m=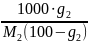
с-молярлық;
N- нормалдығы;
m-молялдығы;
M1-еріген заттың молекулалық массасы;
M2-еріткіштің молекулалық массасы;
Э2- еріген заттың грамм-эквиваленті;
g1, g2-еріткіш пен еріген заттың массасы.
Рауль заңы
Шексіз еритін ерітінділер үшін кез-келген идеалды емес ерітіндінің астындағы еріткіштің қаныққан бу қысымы келесі теңдеумен көрсетіледі:
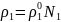
мұнда ρ1 – ерітінді үстіндегі еріткіштің қаныққан бу қысымы;
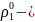 берілген
температурадағы таза еріткіш үстіндегі
қаныққан
бу қысымы;
берілген
температурадағы таза еріткіш үстіндегі
қаныққан
бу қысымы;
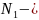 ерітіндідегі
еріткіштің мольдік бөлшегі.
ерітіндідегі
еріткіштің мольдік бөлшегі.
 ді
1-
ді
1-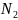 деп
белгілесек:
деп
белгілесек:
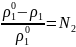
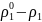 айырымы
еріткіштің қаныққан
бу қысымының төмендеуі.
айырымы
еріткіштің қаныққан
бу қысымының төмендеуі.
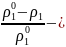 еріткіштің
қаныққан
бу қысымының салыстырмалы төмендеуі.
еріткіштің
қаныққан
бу қысымының салыстырмалы төмендеуі.
Ерітінді астындағы еріткіштің қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік бөлшегіне тең.
Еріген заттың молекулярлық салмағы келесі формула бойынша өрнектеледі:
М2
=
 M1
M1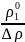
Сұйытылған ерітінділердің қату температуралары
Ерітінділердің қату температуралары таза ерітінділерге қарағанда төмен болады. Ерітіндінің қату температурасының ∆Тқату төмендеуі ерітінідідегі еріген заттың концентрациясына тура пропорционал:
∆Тқату = Кқату∙m
∆Тқату
=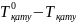
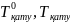 –
еріткіш
пен ерітіндінің қату температурасы,
–
еріткіш
пен ерітіндінің қату температурасы,
Кқату – пропорционалдық коэффициенті немесе криоскопиялық тұрақты,
m – еріген заттың молялдық концентрациясы.
Криоскопиялық тұрақты 1000 г ерітікіштегі 1 моль еріген заты бар кездегі қату температурасының төмендеуі. Криоскопиялық тұрақтыны мына теңдеу бойынша есептейді:
Кқату
=

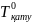 – таза
еріткішітің қату температурасы, К;
– таза
еріткішітің қату температурасы, К;
 -
таза
еріткіштің балқуының мольдік жылуы,
Дж/моль
-
таза
еріткіштің балқуының мольдік жылуы,
Дж/моль
Еріген заттың молекулалық массасын келесі теңдеу бойынша есептейді:
М
=
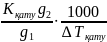
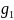
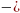 еріткіш
массасы,
еріткіш
массасы,
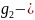 еріген
зат массасы.
еріген
зат массасы.
Сұйытылған ерітінділердің қайнау температурасы
Ерітіндінің қайнау температурасының жоғарылауы ∆Тқайнау еріген заттың молялдық концентрациясына тура пропорционал:
∆Тқайнау = E∙m
∆Т
=
∆Тқайнау
-∆
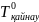
мұнда Тқайнау , - ерітінді мен еріткіштің қайнау температуралары,
Е – пропорционалдық коэффициенті немесе эбуллиоскопиялық тұрақты, мына формуламен өрнектеледі:
Кқайнау
=

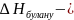 таза
еріткіштің булануының мольдік жылуы,
Дж/моль.
таза
еріткіштің булануының мольдік жылуы,
Дж/моль.
Еріген заттың молекулалық салмағын келесі теңдеумен есептейді:
М1
=

Криоскопиялық Кқайнау және эбуллиоскопиялық Еқ тұрақтылары еріткіш табиғатынан тәуелді, бірақ еріген заттың табиғатына тәуелсіз.
