
- •2. Контрольные задания по теме «Гравиметрические методы анализа»
- •10. Вычислить фактор пересчета (гравиметрический фактор), если определяемое вещество – , гравиметрическая форма – .
- •20. Какой объем 0,1 м потребуется для осаждения хлора из 1 г смеси, содержащей одинаковые массы (г) и , если осадитель добавляется в полуторократном количестве?
- •3. Контрольные задания по теме «Титриметрические методы анализа»
- •10. Рассчитайте и постройте кривую титрования 0,2 м раствора 0,2 н раствором . Выбор индикатора подтвердите расчетами индикаторной ошибки титрования.
- •20. Рассчитайте содержание (в масс. %) FеSо47н2о, если его 2,342 г растворено в 100 см3 раствора и на титрование 30 см3 этого раствора затрачено 13,26 см3 0,05 н раствора перманганата калия.
- •4. Контрольные задания по теме «Электрохимические методы анализа»
- •2. Контрольные задания по теме «Гравиметрические методы анализа»
- •13. Рассчитайте содержание (вмасс. %) , если его 1,3875 г растворено в 100 см3 раствора и на титрование 25 см3 этого раствора затрачено 17,25 см3 0,05 н раствора бихромата калия.
- •4. Контрольные задания по теме «Электрохимические методы анализа»
5. При фотометрическом определении висмута получены следующие значения концентраций (моль/дм3): 8,3510-5; 8,0010-5; 8,5010-5; 8,4510-5; 8,0510-5; 7,9010-5; 8,1710-5. Вычислить стандартное отклонение и доверительный интервал среднего значения (для α=0,95).
Решение
Стандартное отклонение выборки рассчитывают по формуле:
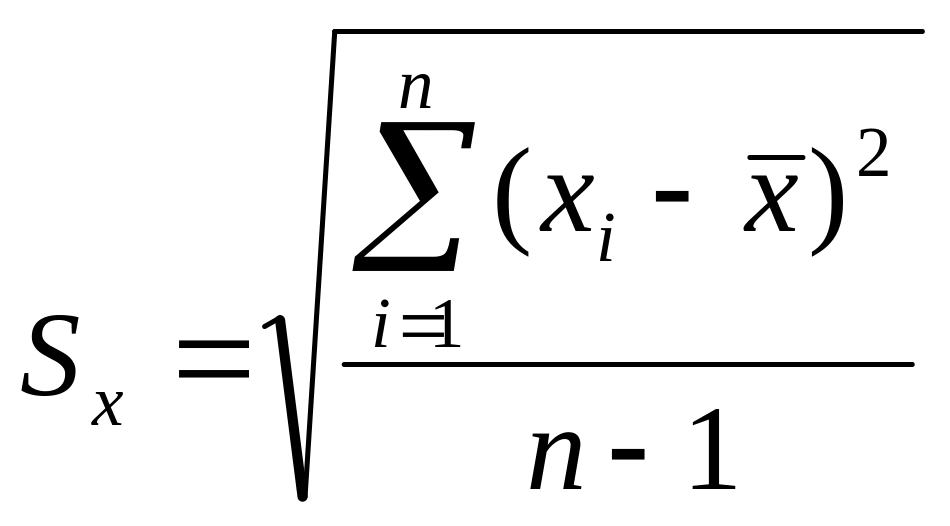
где
![]() – среднее значение, рассчитывается по
формуле:
– среднее значение, рассчитывается по
формуле:
![]()
![]()
![]()
Величину доверительного интервала рассчитывают по формуле:
![]() ,
,
где стандартное отклонение среднего
арифметического (погрешность среднего
арифметического) равна
![]()
![]()
![]()
Ответ: стандартное отклонение
составило
![]() и доверительный интервал среднего
значения
и доверительный интервал среднего
значения
![]() .
.
2. Контрольные задания по теме «Гравиметрические методы анализа»
10. Вычислить фактор пересчета (гравиметрический фактор), если определяемое вещество – , гравиметрическая форма – .
Решение
Фактор пересчета (гравиметрический фактор) рассчитывают по следующей формуле:
![]() ,
,
где
![]() и
и
![]() – стехиометрические коэффициенты в
химических формулах определяемого
вещества и гравиметрической формы.
– стехиометрические коэффициенты в
химических формулах определяемого
вещества и гравиметрической формы.
Следовательно,
![]()
![]()
Ответ: фактор пересчета составил 0,1938.
20. Какой объем 0,1 м потребуется для осаждения хлора из 1 г смеси, содержащей одинаковые массы (г) и , если осадитель добавляется в полуторократном количестве?
Решение
В смеси содержится одинаковые массы
(г)
и
,
следовательно![]() каждого вещества.
каждого вещества.
1. Рассчитаем объем 0,1 М для осаждения хлора при взаимодействии с .
Найдем приблизительное количество
![]() хлорида бария анализируемом растворе:
хлорида бария анализируемом растворе:
![]()
![]()
![]()
Рассчитаем объем
![]() 0,1 моль/л раствора нитрата серебра,
необходимый для стехиометрического
превращения всего хлорида бария в хлорид
серебра. Количество нитрата серебра
требуемое для связывания 0,002 моля хлорида
бария, равно
0,1 моль/л раствора нитрата серебра,
необходимый для стехиометрического
превращения всего хлорида бария в хлорид
серебра. Количество нитрата серебра
требуемое для связывания 0,002 моля хлорида
бария, равно
![]() ,
что следует из стехиометрической
реакции.
,
что следует из стехиометрической
реакции.
В 1000 мл 0,1 моль/л раствора содержится 0,1 моль
В мл 0,1 моль/л того же раствора содержится 0,004 моль
Следовательно,
![]() ,
так как берется полутора кратный избыток,
то
,
так как берется полутора кратный избыток,
то
![]() .
.
2. Рассчитаем объем
![]() для осаждения хлора при взаимодействии
с
.
для осаждения хлора при взаимодействии
с
.
![]() .
.
![]() .
.
![]() .
.
Количество , требуемое для связывания 0,009 моль , также равно 0,009 моль, что следует из стехиометрии реакции.
В 1000 мл 0,1 моль/л – 0,1 моль
В
![]() мл
0,1 моль/л – 0,009 моль
мл
0,1 моль/л – 0,009 моль
Следовательно,
![]() ,
так как берется полутора кратный избыток,
то
,
так как берется полутора кратный избыток,
то
![]() .
.
Ответ:
![]() для осаждения с
равен 60 мл;
для осаждения
равен 135 мл.
для осаждения с
равен 60 мл;
для осаждения
равен 135 мл.
30. Навеску сильвинита массой 5 г растворили в мерной колбе вместимостью 500 см3. Из 10 см3 этого раствора получили 0,1948 г тетрафенилбората калия КВ(С6Н5)4. Вычислить массовую долю (%) КСl во влажном и абсолютно сухом сильвините, если содержание влаги в образце – 2,5%.
Решение
Фактор пересчета
![]()
![]() ;
;
![]()
Если
![]() – масса гравиметрической формы
– масса гравиметрической формы
![]() ,
то масса
,
то масса
![]()
![]() равна:
равна:
![]()
![]() - объем раствора;
- объем раствора;
![]() - объем аликвоты, взятой для анализа.
- объем аликвоты, взятой для анализа.
Если в![]() образца
содержится
образца
содержится
![]() ,
то массовая доля
,
то массовая доля
![]() равна:
равна:
![]()
![]()
Зная массовую долю
![]() и влажность материал
и влажность материал
![]() ,
найдем массовую долю
в сухом веществе:
,
найдем массовую долю
в сухом веществе:
![]()
Ответ: во влажном сильвините содержится
![]() ,
в сухом –
,
в сухом –
![]() .
.
3. Контрольные задания по теме «Титриметрические методы анализа»
10. Рассчитайте и постройте кривую титрования 0,2 м раствора 0,2 н раствором . Выбор индикатора подтвердите расчетами индикаторной ошибки титрования.
Решение
![]()
Уксусная кислота – слабая кислота, а – сильное основание, поэтому в данном случае рассмотрим титрование слабой кислоты сильным основанием. Расчет проводим без учета изменения объема раствора.
Предположим, что для титрования взяли
100,00 мл
![]() раствора
раствора
![]() .
Рассчитаем объем раствора
.
Рассчитаем объем раствора
![]() ,
необходимый для полного оттитровывания
.
,
необходимый для полного оттитровывания
.
![]() ;
;
![]()
1.
![]() исходного раствора рассчитываем по
формуле для расчета
слабой кислоты:
исходного раствора рассчитываем по
формуле для расчета
слабой кислоты:
![]()
2. В любой момент титрования до точки эквивалентности в растворе существует буферная смесь, состоящая из неоттитрованной уксусной кислоты и образовавшегося ацетата калия.
Концентрацию кислоты и соли можно рассчитать:
![]() ;
;
![]()
Отсюда отношение концентраций можно рассчитать как:
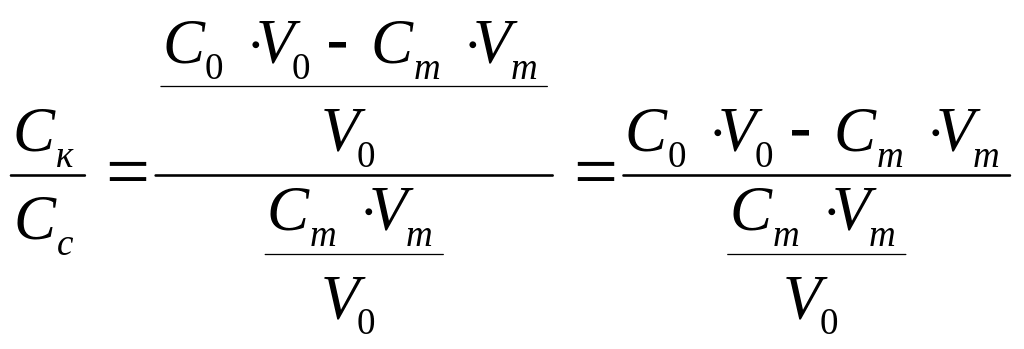
Следовательно, формула для расчета имеет вид:
![]()
При добавлении 50,0 мл (50%) раствора :
![]()
Таки же образом рассчитываем при прибавлении 90,00 мл раствора (90%):
![]()
При добавлении 99,0 мл раствора (99%):
![]()
При добавлении 99,9 млраствора (99,9%), что соответствует точки начала скачка титрования:
![]()
3. В точке эквивалентности вся уксусная
кислота прореагировала и превратилась
в соль, концентрация которой
![]() .
раствора соли слабой кислоты рассчитывают
по формуле:
.
раствора соли слабой кислоты рассчитывают
по формуле:
![]()
4. За точкой эквивалентности величина раствора определяется только избытком добавленного титранта. Расчет проводится при добавлении 100,1 мл раствора (100,1%).
![]()
При добавлении 101,0 мл раствора (101%)
![]()
При добавлении 110,0 мл раствора (110%)
![]()
Результаты сведем в таблицу, по данным которой построим кривую титрования:
Объем титранта,
|
– определяющий компонент |
Формула для расчета |
|
0 |
|
|
2,72 |
50,0 |
и
|
|
4,75 |
90,0 |
и |
|
5,70 |
99,0 |
и |
|
6,75 |
99,9 |
и |
|
7,75 |
100,0 |
|
|
9,03 |
100,1 |
|
|
10,30 |
101,0 |
|
|
11,30 |
110,0 |
|
|
12,30 |
Рис 1
Выбираем подходящие индикаторы: феноловый красный (интервал перехода6,4-8,0); тимоловый синий (интервал перехода 8,0-9,6); фенолфталеин (интервал перехода8,0-9,6), поскольку интервалы перехода этих индикаторов лежат в пределах скачка кривой титрования.
Найдем индикаторную ошибку титрования на примере индикатора тимолового синего.
Уравнение реакции титрования:
![]() ,
,
![]() ,
индикатор тимоловый синий (интервал
перехода индикатора 8,0-9,6). В конечной
точке титрования
,
индикатор тимоловый синий (интервал
перехода индикатора 8,0-9,6). В конечной
точке титрования
![]()
![]() ,
следовательно, в конечной точке титрования
более кислая среда, чем в Т.Э. (избыток
слабой уксусной кислоты), т.е. реализуется
кислотная ошибка титрования. Раствор
недотитрован – знак ошибки «-».
,
следовательно, в конечной точке титрования
более кислая среда, чем в Т.Э. (избыток
слабой уксусной кислоты), т.е. реализуется
кислотная ошибка титрования. Раствор
недотитрован – знак ошибки «-».
![]()
Индикаторная ошибка титрования по абсолютной величине меньше 0,2%, поэтому индикатор можно использовать при титровании.
