
Проверка знаний по всему курсу. Часть 1 (pdf)
.pdf
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
ЧАСТЬ I
Для студентов биологического факультета
Барнаул • 2000
Составители: И.Б. Катраков, канд. хим. наук В.И. Маркин, канд. хим. наук О.А. Панченко
П.И. Сиянко, канд. хим. наук, доцент
Представленное пособие является рабочей тетрадью, для самостоятельной работы студентов при изучении органической химии по модульно рейтинговой технологии обучения. Предназначено для студентов очного и вечернего отделений по специальности 01.09 "Биология".
Пособие может быть полезно студентам нехимических специальностей вузов, школьникам специализированных классов, а также всем интересующимся органической химией.
Подписано в печать 21.08.2000. Формат 60*80/16. Бумага офсетная. Печать офсетная. Усл. п.л. 1,3. Тираж 100 экз. Заказ
Типография Алтайского государственного университета: 656099, Барнаул, ул. Димитрова, 66

3
Студент(ка) |
|
Группа |
|
Фамилия, имя, отчество |
|
Указания к выполнению задания: Предлагаемое Вашему вниманию задание предназначено для самостоятельной работы в свободное от аудиторных занятий время. Задания предполагают индивидуальное и самостоятельное выполнение! Только в этом случае Вас ждет успех при изучении органической химии.
Задание состоит из нескольких разделов. Только первый раздел "Программа" носит информативный характер и определяет тот минимум знаний, которым Вы должны владеть после выполнения данной модульной программы. Все ответы на упражнения в остальных разделах следует вносить в данное задание на свободном, специально предназначенном для этого месте. После ответа на все вопросы данное задание сдается преподавателю, ведущему лабораторные занятия.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
ПРОГРАММА
Введение. Предмет органической химии. История возникновения органической химии и причины выделения в самостоятельную науку. Органическая химия в ряду других наук, связь ее с биологией и медициной.
Строение и номенклатура органических соединений. Теория химического строения органических соединений (А.М. Бутлеров). Предпосылки ее возникновения. Основные положения. Современное состояние теории химического строения. Методы выделения и очистки органических веществ. Качественный и количественный анализ. Химические формулы. Типы: простейшие, молекулярные, структурные, пространственные. Модели молекул (шаростержневые и объемные). Явление изомерии. Структурная изомерия. Первичный, вторичный и третичный атомы углерода. Углеводородный радикал и функциональная группа. Функциональная изомерия.
4
Классификация органических соединений по химическим функциям: углеводороды (предельные, непредельные, циклические, ароматические); производные углеводородов, содержащие функции с одним гетероатомом (галогенпроизводные, спирты, енолы, фенолы, простые эфиры, амины, металлорганические соединения); производные углеводородов со сложными функциями (нитросоединения, сульфокислоты, оксосоединения, кислоты; соединения со смешанными функциями; гетероциклические соединения). Понятия: гомологи, гомологический ряд. Представления об элементоорганических соединениях.
Номенклатура органических соединений; тривиальная, рациональная. Правила построения названия по номенклатуре ИЮПАК.
Образование связей в соединениях углерода. Ковалентная связь. Электронные формулы Льюиса. Квантово-механические представления о строении атома углерода. Атомные и молекулярные орбитали. Гибридизация и принцип максимального перекрывания атомных орбиталей при образовании химических связей. Три вида гибриди-
зации. σ - и π -связи. Одинарная, двойная и тройная углерод-углеродные связи. Образование ковалентной связи, ее свойства и характеристики: направленность, насыщаемость, длина, энергия, полярность, поляризуемость. Типы связей углерод-гетероатом. Энергия, длины и полярности одинарных и кратных С-Х связей. Семиполярные связи.
Взаимное влияние атомов в молекуле. Поляризация ковалентных связей и индуктивный эффект как один из способов передачи влияния атомов в пространстве. Эффект сопряжения - один из важнейших в ненасыщенных системах. Теория резонанса и ее критерии. Индуктивные и мезомерные константы заместителей.
Стереохимия органических соединений. Теория тетраэдрического углеродно-
го атома Вант-Гоффа. Пространственное строение метана и его гомологов. Принцип свободного вращения вокруг углерод-углеродных связей и пределы его применимости. Понятие о конформациях этана. Конформации циклических соединений: циклобутана, циклопентана, циклогексана и высших алициклов. Оптически активные вещества. Хиральный атом углерода. Общее условие появления оптической активности. Оптические антиподы и рацемические соединения. R-, S-номенклатура. Проекционные формулы Фишера и правила пользования ими. Оптическая активность соединений, не содержащих хиральных атомов углерода. Строение этиленовых соединений. Геометрическая (цис-, транс-) изомерия в ряду непредельных и циклических соедине-

5
ний. Условия ее появления в ряду олефинов и циклоалканов. Стереохимия азот-, ки- слород-, и серусодержащих соединений.
Реакционная способность органических соединений. Электронная теория ор-
ганических реакций. Гомолитические и гетеролитические реакции. Реагенты радикальные, нуклеофильные и электрофильные. Классификация реакционных механизмов. Органические радикалы, катионы, анионы, бирадикалы, биполярные ионы, их строение, энергия образования, влияние заместителей на устойчивость. Пути стабилизации этих частиц. Аллильные и бензильные радикалы и ионы.
Основные типы органических реакций. Реакции органических соединений.
Типы разрыва связей: гомо- и гетеролитический. Представление о механизме реакций. Классификация реагентов: радикалы, электрофилы, нуклеофилы. Классификация органических реакций по изменению в субстрате: замещение, присоединение, отщепление, изомеризация, разложение, окисление, восстановление. Классификация по характеру активных частиц: радикальные, ионные, нуклеофильные, электрофильные.
Методы установления структуры органических молекул. Химические мето-
ды определения строения. Принцип наименьшего изменения строения при химических реакциях. Основные физические методы установления структуры: ИК-, УФ- и ЯМР-спектроскопия.
ОСНОВНЫЕ ТЕРМИНЫ, ПОНЯТИЯ, ОПРЕДЕЛЕНИЯ
Дайте определение следующим понятиям:
Атомная орбиталь –
Ковалентная связь –
Лимитирующая стадия реакции –
Механизм реакции –

6
Нуклеофильный реагент –
Оптическая изомерия –
Радикал –
Структурная формула –
Электрофильный реагент –
КЛАССИФИКАЦИЯ, ИЗОМЕРИЯ, ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ
1. Приведите структурные формулы для следующих соединений:
C6H5NO2 |
CH2N2 |
|
|
2. В нижеприведенном соединении укажите функциональные группы.
A |
|
|
O |
E |
|
B |
||
|
||
C |
F H |
|
O |
||
DH2N |
|
|
G OH |
O |
а) карбоксильная группа б) кето-группа в) амино-группа
г) простая эфирная группа д) двойная связь
O
7 3. Отметьте истинные (И) и ложные (Л) утверждения теории химического
строения А.М. Бутлерова.
а) |
Атомы в молекулах соединены друг с другом химическими связями в со- |
__ |
|
ответствии с их валентностью |
|
|
|
|
б) |
Свойства органических соединений зависят только от числа и природы |
__ |
|
входящих в их состав атомов |
|
|
|
|
в) |
В молекулах существует взаимное влияние атомов как связанных, так и |
__ |
|
непосредственно друг с другом не связанных |
|
|
|
|
г) |
Химическое строение вещества можно определить в результате изучения |
|
|
его химических превращений и, наоборот, по строению вещества можно |
__ |
|
характеризовать его свойства |
|
|
|
|
д) |
В молекулах существует взаимное влияние друг на друга только непосред- |
__ |
|
ственно связанных друг с другом атомов |
|
|
|
|
е) |
Атом углерода имеет валентность четыре |
__ |
|
|
|
ж) |
Атомы в молекулах органических веществ соединяются между собой в |
__ |
|
определенной последовательности |
|
|
|
|
|
4. |
|
Отметьте структуру, |
|
которая является |
изомером |
молочной |
кислоты |
|||||||||||
(CH3CH(OH)COOH). |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
CH3 |
|
CH |
|
CH2 |
|
COOH |
|
CH2 |
|
COOCH3 |
|
O |
|
|
OH |
O |
||
а) |
|
|
|
б) |
|
в) CH3 |
CH C |
г) |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
OH |
OH |
|
|
H |
CH3 |
CH |
C |
||||||||||
|
|
|
|
|
|
|
OH |
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
5. В нижеприведенных соединениях отметьте (*) хиральный атом углерода (если он есть!).
|
|
|
CH3 |
|
|
I |
|
|
|
|
CH3 |
CH3 |
|||||
|
|
|
|
|
|
|
CH3CH2 |
|
CHCOOH |
|
|||||||
CH3 |
|
C |
|
CH3 |
Cl |
|
C |
|
Br |
|
|
|
HC CH |
||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
д) H3C |
||||
а) |
|
CH3 |
б) |
|
CH3 в) |
|
NH2 |
г) |
|
||||||||
6. Расположите следующие группы в порядке уменьшения их старшинства в системе Кана–Ингольда–Прелога:
а) –OH, –Cl, –CHO б) –F, –Cl, –Br, –I
в) –CH3, –CH2CH3, –C(CH3)3

8
7. Определите абсолютную конфигурацию хирального атома углерода в нижеприведенных соединениях.
|
|
|
|
CH3 |
CH3 |
|
|
в) |
|
|
|
|
|
|
_______ |
C H |
|
_______ |
|
_______ |
|||
Br |
|
|
|
Br |
|
||||||
|
|
|
|
|
|
|
|
|
|||
F |
C |
H |
|
|
C |
H |
|
|
C |
Cl |
|
|
|
|
H |
C |
|
CH3 |
|||||
|
|
|
|
CH3 |
|
|
|
||||
а) Cl |
|
|
|
Br |
H |
|
|
H |
|
|
|
|
|
|
б) |
|
|
|
|
||||
8. Укажите наиболее энергетически выгодную конформацию 1,2-дихлорэтана. |
|||||||||||
H |
Cl |
Cl |
Cl H |
Cl |
|
Cl Cl |
H |
Cl |
|||
|
|
|
Cl |
H |
|
|
H |
||||
H |
|
H |
H |
|
H |
H |
H |
|
H |
H |
|
H |
H |
ClH |
H |
HH |
|||||||
|
|
H |
|
|
Cl |
||||||
|
A |
|
B |
|
C |
|
|
D |
|
E |
|
9. Эта конформация называется _________________________________ .
10. Конформация С в задании 8 называется _______________________ .
11. Изобразите заторможенные конформации следующих соединений относительно указанных в скобках связей:
бутан (С2-С3) |
1,2-дихлорбутан (С1-С2) |
||
клиновидная |
проекция Ньюмена |
клиновидная |
проекция Ньюмена |
проекция |
|
проекция |
|
|
|
|
|
9
ЭЛЕКТРОННОЕ СТРОЕНИЕ. ПРОМЕЖУТОЧНЫЕ ЧАСТИЦЫ.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ
1. Изобразите схематически орбитали 1s-, 2s- и 2p-электронов.
2. Какие типы гибридизации возможны для атома углерода? Изобразите пространственные модели возможных гибридных орбиталей атома углерода.
3. В нижеприведенном соединении буквами A, B, C обозначьте тип гибридизации указанных атомов.
|
CH2 |
|
|
C |
|
O |
CH |
A - sp3 |
|
|
|
|
|
B - sp2 |
O |
H |
C - sp |
|
||
H2N |
|
|
|
OH O |
|
|
O |
|
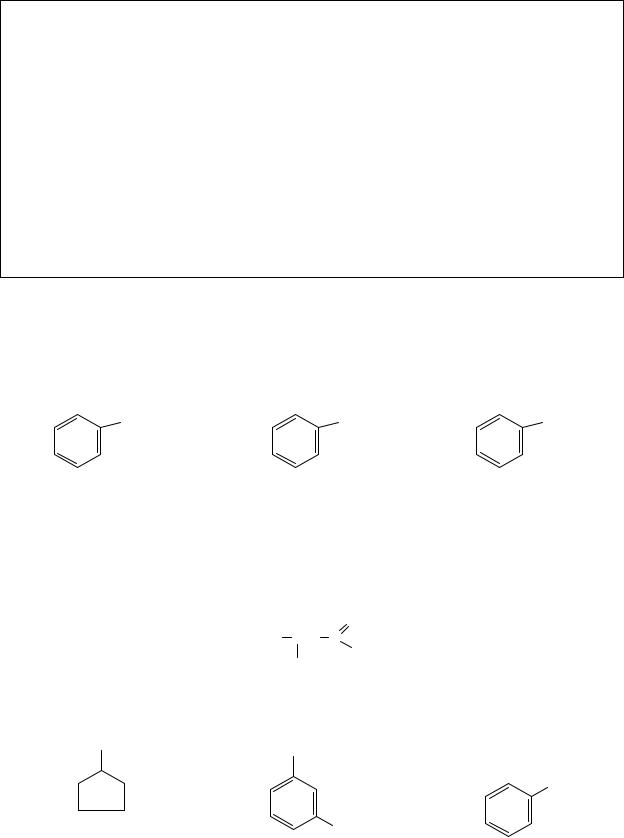
10 |
|
|
|
|
4. |
Проиллюстрируйте образование σ - и π -связей на примере пропина |
|||
(CH3 |
|
C |
|
CH). Нарисуйте перекрывание гибридных орбиталей. На рисунке укажите |
|
|
|||
|
|
|||
|
|
|||
тип гибридизации каждого углеродного атома.
5. Укажите графически распределение электронной плотности в нижеприведенных соединениях: Назовите все, присутствующие эффекты.
CH3 |
OH |
COOH |
|
CH3 |
|
|
CH2 |
|
|
|
Br |
CH2 |
|
CH2 |
|
Br |
CH2 |
|
CH |
|
CH2 |
|
Br |
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
CH3 CH2 |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
C |
|
|
CH2 |
|
|
C |
|
CH3 |
|
|
|
CH2 |
|
CH |
|
CH |
|
CH |
|
Cl |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Br |
CH3 |
|
|
|
NO2 |
|
NH2 |
