
- •Учебное пособие для выполнения домашних заданий
- •2.2.5. Примеры решения задач
- •1. Основные классы неорганических соединений
- •Гидроксиды
- •NaOh – гидроксид натрия; Fe(oh)3 – гидроксид железа (III).
- •Ион гидроксожелеза(II)
- •Кислоты
- •Гидросульфид ион
- •Сульфид ион
- •2. Взаимодействие веществ
- •2.1. Химическая термодинамика
- •2.1.1. Основные понятия
- •2.1.2. Энергетика химических процессов (термохимические расчеты). Первый закон термодинамики
- •2.1.3. Энтропия. Химическое сродство. Второй закон термодинамики
- •2.1.4. Условия самопроизвольного протекания процессов. Третий закон термодинамики
- •2.1.5. Примеры решения задач
- •2.2. Химическая кинетика
- •2.2.2. Влияние температуры на скорость реакции
- •2.2.3. Химическое равновесие. Константа равновесия
- •Смещение химического равновесия. Принцип Ле Шателье
- •Примеры решения задач
- •Изменить температуру. Т. К реакция получения аммиака экзотермическая (идет с выделением тепла), то температуру надо понизить (по принципу Ле Шателье).
- •3. Растворы и реакции в водных растворах
- •3.1. Концентрации растворов
- •3.1.1. Способы задания концентрации растворов
- •3.1.2. Закон эквивалентов
- •3.1.3. Пример решения задачи
- •3.2. Теория растворов
- •3.2.1. Давление пара растворов
- •3.2.2. Кипение и замерзание растворов
- •3.2.3. Осмос. Осмотическое давление
- •3.2.4. Количественные характеристики растворов электролитов. Закон растворения
- •(В отн. Единицах, если умножить на 100%, то в %).
- •3.2.5. Произведение растворимости. Условие образования осадка
- •3.2.6. Примеры решения задач
- •3.3 Ионное произведение воды и водородный показатель. Гидролиз солей
- •3.3.1. Ионное произведение воды и водородный показатель
- •3.3.2. Гидролиз солей
- •Соли слабого основания и сильной кислоты
- •Слабое основание сильная кислота
- •Соли сильного основания и слабой кислоты
- •Сильное основание слабая кислота
- •Соли слабого основания и слабой кислоты
- •Слабое основание слабая кислота
- •3.3.3. Примеры решения задач
- •3.4. Комплексные соединения
- •3.4.1. Общие понятия о структуре комплексного соединения
- •В молекуле комплексного соединения один из ионов (обычно катион) занимает центральное место и называется комплексообразователем или центральным ионом.
- •Остальные ионы находятся на более далеком расстоянии от комплексообразователя и составляют внешнюю координационную сферу (ион внешней сферы или внешний ион).
- •Номенклатура комплексных соединений
- •(Nh4)2[Pt(oh)2Cl4] – тетра – хлоро, ди – гидроксо платинат (IV) аммония.
- •Примеры решения задач
- •3.5.3. Примеры решения задач
- •I. Для того, чтобы найти частицы, в которые входят атомы, меняющие свою степень окисления, определим степень окисления всех атомов.
- •II. Разделить овр на две полуреакции. Уравнять в полуреакциях сначала частицы, затем заряды.
- •Если число частиц кислорода в полуреакции больше слева – это освобождающиеся частицы. Если частиц кислорода в полуреакции больше справа – это недостающие частицы кислорода. В нашей полуреакции
- •IV. После выполнения химическо-математических операций перенести полученные коэффициенты в исходное уравнение, сделать проверку, и расставить недостающие коэффициенты, если это необходимо.
- •Пример решения задачи
- •Усиление окислительных свойств →
- •Массы или объемы веществ, испытавшие электрохимические превращения на электродах, прямо пропорциональны количеству прошедшего электричества:
- •V(b) – объем газообразного вещества при н.У., претерпевшего электрохимическое превращение на электроде, дм3;
- •4.2.6. Примеры решения задач
- •MgCl2 ∙ 6CaCl.
- •Соединений (при 298 к)
2.2. Химическая кинетика
2.2.1. Закон действия масс (закон Гультберга-Вааге)
Закон определяет зависимость скорости химической реакции от концентраций реагирующих веществ. Этот закон называется также основным кинетическим законом.
Пусть уравнение реакции имеет вид:
аА + bВ... = сС + dD,
где буквами a, b, c, d обозначены стехиометрические коэффициенты в уравнении реакции (они могут принимать значения 1, 2, 3, 4...), буквами A, B, C, D – формулы веществ, участвующих в процессе (исходные веществ – слева А и В, и продукты реакции – справа С и D могут быть любыми). Тогда скорость реакции согласно основному кинетическому закону определяется как:
![]() ,
,
где
![]() – скорость химической реакции получения
C
и D
из веществ А
и В;
[A]
и [B]
– молярные концентрации веществ A
и B,
единица измерения –
– скорость химической реакции получения
C
и D
из веществ А
и В;
[A]
и [B]
– молярные концентрации веществ A
и B,
единица измерения –
![]() или
или
![]() ;
a
и b
– коэффициенты из уравнения реакции
становятся показателями степени; k
– константа скорости; она равна скорости
реакции при одномолярных концентрациях
веществ. Уравнение скорости называется
кинетическим уравнением.
;
a
и b
– коэффициенты из уравнения реакции
становятся показателями степени; k
– константа скорости; она равна скорости
реакции при одномолярных концентрациях
веществ. Уравнение скорости называется
кинетическим уравнением.
2.2.2. Влияние температуры на скорость реакции
Шведским учёным С. Аррениусом установлена зависимость константы скорости реакции (а значит и скорости реакции) от температуры. Полученное им уравнение названо его именем:
![]() или
или
![]() ,
,
где
k0
– предэксионенциальный множитель; R
– универсальная газовая постоянная
(8,31
![]() );
Еа
– энергия активации реакции (
);
Еа
– энергия активации реакции (![]() ).
).
Энергия активации реакции – это избыточное количество энергии, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества (продукта реакции). Значение Еа определяется природой реакции и лежит в пределах 40─400 кДж/моль.
Используя зависимость Аррениуса для определения константы скорости реакции при разных температурах, можно получить уравнение, позволяющее определить либо энергию активации (при известных константах скорости), либо рассчитать отношение констант скорости при двух температурах:
![]() .
.
Здесь k1 и k2 – константы скорости реакции при температурах Т1 и Т2 соответственно; коэффициент 2,3 появляется при переходе от натурального логарифма (ln) и десятичному (lg).
Аппроксимируя сложную зависимость Аррениуса более простой, голландский учёный Вант-Гофф предложил правило, согласно которому повышение температуры на каждые 100С повышает скорость реакции в несколько раз. Это означает, что с ростом температуры увеличивается константа скорости реакции:
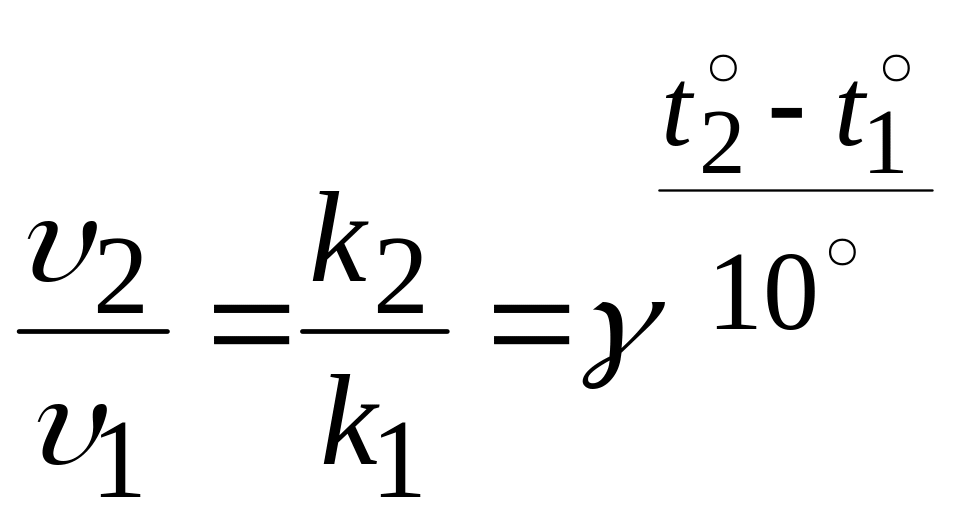 ,
,
где
![]() и
и
![]() – скорости реакции при температурах
– скорости реакции при температурах
![]() и
и
![]() соответственно;
k1
и k2
– константы скорости реакции при
температурах
и
;
соответственно;
k1
и k2
– константы скорости реакции при
температурах
и
;
![]() (гамма) – температурный коэффициент
скорости химической реакции. Он
показывает, во сколько раз увеличится
скорость реакции при повышении температуры
на каждые 10°С.
Для большинства реакций температурный
коэффициент принимает значения от 1,5
до 4.
(гамма) – температурный коэффициент
скорости химической реакции. Он
показывает, во сколько раз увеличится
скорость реакции при повышении температуры
на каждые 10°С.
Для большинства реакций температурный
коэффициент принимает значения от 1,5
до 4.
Согласно правилу Вант-Гоффа величина для каждой реакции имеет своё значение. Однако на практике это не всегда выполняется. Обычно значение температурного коэффициента уменьшается при повышении температуры. В связи с этим правило рекомендуют использовать лишь для узких диапазонов температур, т.к. в этом случае изменением величины можно пренебречь.
