
- •Учебное пособие для выполнения домашних заданий
- •2.2.5. Примеры решения задач
- •1. Основные классы неорганических соединений
- •Гидроксиды
- •NaOh – гидроксид натрия; Fe(oh)3 – гидроксид железа (III).
- •Ион гидроксожелеза(II)
- •Кислоты
- •Гидросульфид ион
- •Сульфид ион
- •2. Взаимодействие веществ
- •2.1. Химическая термодинамика
- •2.1.1. Основные понятия
- •2.1.2. Энергетика химических процессов (термохимические расчеты). Первый закон термодинамики
- •2.1.3. Энтропия. Химическое сродство. Второй закон термодинамики
- •2.1.4. Условия самопроизвольного протекания процессов. Третий закон термодинамики
- •2.1.5. Примеры решения задач
- •2.2. Химическая кинетика
- •2.2.2. Влияние температуры на скорость реакции
- •2.2.3. Химическое равновесие. Константа равновесия
- •Смещение химического равновесия. Принцип Ле Шателье
- •Примеры решения задач
- •Изменить температуру. Т. К реакция получения аммиака экзотермическая (идет с выделением тепла), то температуру надо понизить (по принципу Ле Шателье).
- •3. Растворы и реакции в водных растворах
- •3.1. Концентрации растворов
- •3.1.1. Способы задания концентрации растворов
- •3.1.2. Закон эквивалентов
- •3.1.3. Пример решения задачи
- •3.2. Теория растворов
- •3.2.1. Давление пара растворов
- •3.2.2. Кипение и замерзание растворов
- •3.2.3. Осмос. Осмотическое давление
- •3.2.4. Количественные характеристики растворов электролитов. Закон растворения
- •(В отн. Единицах, если умножить на 100%, то в %).
- •3.2.5. Произведение растворимости. Условие образования осадка
- •3.2.6. Примеры решения задач
- •3.3 Ионное произведение воды и водородный показатель. Гидролиз солей
- •3.3.1. Ионное произведение воды и водородный показатель
- •3.3.2. Гидролиз солей
- •Соли слабого основания и сильной кислоты
- •Слабое основание сильная кислота
- •Соли сильного основания и слабой кислоты
- •Сильное основание слабая кислота
- •Соли слабого основания и слабой кислоты
- •Слабое основание слабая кислота
- •3.3.3. Примеры решения задач
- •3.4. Комплексные соединения
- •3.4.1. Общие понятия о структуре комплексного соединения
- •В молекуле комплексного соединения один из ионов (обычно катион) занимает центральное место и называется комплексообразователем или центральным ионом.
- •Остальные ионы находятся на более далеком расстоянии от комплексообразователя и составляют внешнюю координационную сферу (ион внешней сферы или внешний ион).
- •Номенклатура комплексных соединений
- •(Nh4)2[Pt(oh)2Cl4] – тетра – хлоро, ди – гидроксо платинат (IV) аммония.
- •Примеры решения задач
- •3.5.3. Примеры решения задач
- •I. Для того, чтобы найти частицы, в которые входят атомы, меняющие свою степень окисления, определим степень окисления всех атомов.
- •II. Разделить овр на две полуреакции. Уравнять в полуреакциях сначала частицы, затем заряды.
- •Если число частиц кислорода в полуреакции больше слева – это освобождающиеся частицы. Если частиц кислорода в полуреакции больше справа – это недостающие частицы кислорода. В нашей полуреакции
- •IV. После выполнения химическо-математических операций перенести полученные коэффициенты в исходное уравнение, сделать проверку, и расставить недостающие коэффициенты, если это необходимо.
- •Пример решения задачи
- •Усиление окислительных свойств →
- •Массы или объемы веществ, испытавшие электрохимические превращения на электродах, прямо пропорциональны количеству прошедшего электричества:
- •V(b) – объем газообразного вещества при н.У., претерпевшего электрохимическое превращение на электроде, дм3;
- •4.2.6. Примеры решения задач
- •MgCl2 ∙ 6CaCl.
- •Соединений (при 298 к)
Кислоты
Кислота – сложное вещество, в молекуле которого имеется один или несколько атомов водорода, которые могут быть замещены атомами (ионами) металлов или аммонием.
Оставшаяся часть молекулы кислоты называется кислотным остатком.
По количеству частиц водорода, способных замещаться в химических реакциях, кислоты подразделяются на одно-, двух-, и многоосновные:
HNO3; HCl; HCN – одноосновные кислоты;
H2SO4; H2CO3; H2S – двухосновные кислоты.
Как электролиты кислоты могут быть сильными и слабыми.
Кислоты – сильные электролиты:
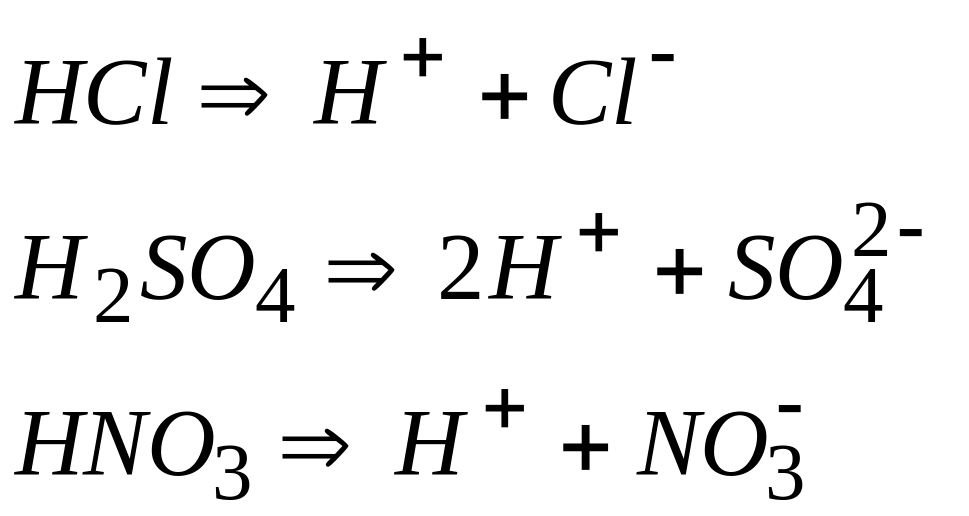
Кислоты – слабые электролиты диссоциируют ступенчато:
![]()
Гидросульфид ион
![]()
Сульфид ион
По природе кислотного остатка кислоты подразделяются на бескислородные:
![]()
и кислородсодержащие:
![]()
Названия кислот определяются природой кислотного остатка:
H2S – сероводородная кислота;
HCN – циановодородная кислота.
Названия кислородсодержащих кислот зависят от степени окисления центрального атома кислотного остатка.
Если центральный атом находится в высшей степени окисления, то название кислоты имеет окончание «ная»:
HNO3 – азотная.
Если центральный атом кислотного остатка находится не в наивысшей степени окисления, то название кислоты имеет окончание «истая»:
HNO2 – азотистая.
Соли
Все соли – сильные электролиты, образующиеся в результате реакции нейтрализации кислоты основанием.
Соли подразделяются на:
средние,
кислые,
основные,
двойные,
смешанные.
Средние соли образуются, если гидроксид и кислота взаимодействуют в эквивалентном отношении. Молекула средней соли состоит из катиона металла или аммония и кислотного остатка кислоты:
MgCO3 – карбонат магния;
(NH4)2S – сульфид аммония.
Диссоциируют средние соли на ионы металла (аммония) и кислотного остатка.
![]()
Кислые соли возможны для многоосновных кислот (H2SO4; H3PO4 …), в которых ионы Н+ частично замещены на ионы металла или аммония:
NaHCO3 – гидрокарбонат натрия.
В названии кислой соли присутствует приставка «гидро».
NH4H2PO4 – дигидрофосфат аммония.
Кислые соли диссоциируют на ионы металла (аммония) и кислотный остаток, включающий одну или несколько частиц водорода:
![]()
Основные соли образуются в том случае, если гидроксид является многокислотным (Fe(OH)2, Al(ОН)3 . . . ), а кислота взята в недостатке:
Al(ОН)3 + НСl Al(ОН)2 Сl + Н2О или, что то же самое: Аl ОН ОН ОН + НCl Al(ОН)2 Сl + Н2О.
В названии основной соли присутствует приставка «гидроксо». Присутствие нескольких ионов обозначается греческим числительным.
Al(OH)2Cl – хлорид дигидроксо алюминия;
(Fe(OH)2)2SO4 – сульфат дигидроксо железа (III).
Основные соли диссоциируют на сложные катионы, состоящие из иона металла и гидроксогруппы и ионы кислотного остатка:
![]()
Соли, образованные двумя металлами и одной кислотой, называются двойными солями.
![]() – сульфат
кальция алюминия (алюмокальциевые
квасцы):
– сульфат
кальция алюминия (алюмокальциевые
квасцы):
![]() .
.
Соли, образованные одним катионом и двумя разными кислотами, называются смешанными.
![]() (или
(или
![]() )
– кальциевая соль хлороводородной (
)
– кальциевая соль хлороводородной (![]() )
и хлорноватистой (
)
и хлорноватистой (![]() )
кислот:
)
кислот:
![]() .
.
