
- •Учебное пособие для выполнения домашних заданий
- •2.2.5. Примеры решения задач
- •1. Основные классы неорганических соединений
- •Гидроксиды
- •NaOh – гидроксид натрия; Fe(oh)3 – гидроксид железа (III).
- •Ион гидроксожелеза(II)
- •Кислоты
- •Гидросульфид ион
- •Сульфид ион
- •2. Взаимодействие веществ
- •2.1. Химическая термодинамика
- •2.1.1. Основные понятия
- •2.1.2. Энергетика химических процессов (термохимические расчеты). Первый закон термодинамики
- •2.1.3. Энтропия. Химическое сродство. Второй закон термодинамики
- •2.1.4. Условия самопроизвольного протекания процессов. Третий закон термодинамики
- •2.1.5. Примеры решения задач
- •2.2. Химическая кинетика
- •2.2.2. Влияние температуры на скорость реакции
- •2.2.3. Химическое равновесие. Константа равновесия
- •Смещение химического равновесия. Принцип Ле Шателье
- •Примеры решения задач
- •Изменить температуру. Т. К реакция получения аммиака экзотермическая (идет с выделением тепла), то температуру надо понизить (по принципу Ле Шателье).
- •3. Растворы и реакции в водных растворах
- •3.1. Концентрации растворов
- •3.1.1. Способы задания концентрации растворов
- •3.1.2. Закон эквивалентов
- •3.1.3. Пример решения задачи
- •3.2. Теория растворов
- •3.2.1. Давление пара растворов
- •3.2.2. Кипение и замерзание растворов
- •3.2.3. Осмос. Осмотическое давление
- •3.2.4. Количественные характеристики растворов электролитов. Закон растворения
- •(В отн. Единицах, если умножить на 100%, то в %).
- •3.2.5. Произведение растворимости. Условие образования осадка
- •3.2.6. Примеры решения задач
- •3.3 Ионное произведение воды и водородный показатель. Гидролиз солей
- •3.3.1. Ионное произведение воды и водородный показатель
- •3.3.2. Гидролиз солей
- •Соли слабого основания и сильной кислоты
- •Слабое основание сильная кислота
- •Соли сильного основания и слабой кислоты
- •Сильное основание слабая кислота
- •Соли слабого основания и слабой кислоты
- •Слабое основание слабая кислота
- •3.3.3. Примеры решения задач
- •3.4. Комплексные соединения
- •3.4.1. Общие понятия о структуре комплексного соединения
- •В молекуле комплексного соединения один из ионов (обычно катион) занимает центральное место и называется комплексообразователем или центральным ионом.
- •Остальные ионы находятся на более далеком расстоянии от комплексообразователя и составляют внешнюю координационную сферу (ион внешней сферы или внешний ион).
- •Номенклатура комплексных соединений
- •(Nh4)2[Pt(oh)2Cl4] – тетра – хлоро, ди – гидроксо платинат (IV) аммония.
- •Примеры решения задач
- •3.5.3. Примеры решения задач
- •I. Для того, чтобы найти частицы, в которые входят атомы, меняющие свою степень окисления, определим степень окисления всех атомов.
- •II. Разделить овр на две полуреакции. Уравнять в полуреакциях сначала частицы, затем заряды.
- •Если число частиц кислорода в полуреакции больше слева – это освобождающиеся частицы. Если частиц кислорода в полуреакции больше справа – это недостающие частицы кислорода. В нашей полуреакции
- •IV. После выполнения химическо-математических операций перенести полученные коэффициенты в исходное уравнение, сделать проверку, и расставить недостающие коэффициенты, если это необходимо.
- •Пример решения задачи
- •Усиление окислительных свойств →
- •Массы или объемы веществ, испытавшие электрохимические превращения на электродах, прямо пропорциональны количеству прошедшего электричества:
- •V(b) – объем газообразного вещества при н.У., претерпевшего электрохимическое превращение на электроде, дм3;
- •4.2.6. Примеры решения задач
- •MgCl2 ∙ 6CaCl.
- •Соединений (при 298 к)
3.2.6. Примеры решения задач
Задача № 1.
Найти степень диссоциации гидроксида калия, если раствор, содержащий 4,2 г вещества и 0,5 дм3 воды, замерзает при -0,5°С.
-
Дано:
mB = 4,2 г
Vводы = 0,5 дм3
t°зам р-ра = - 0,5°С
-----------------------
αкаж - ?
Решение:
КОН → К+ + ОН- → n = 2 – сильный электролит
∆t°зам = i · kк · СМ
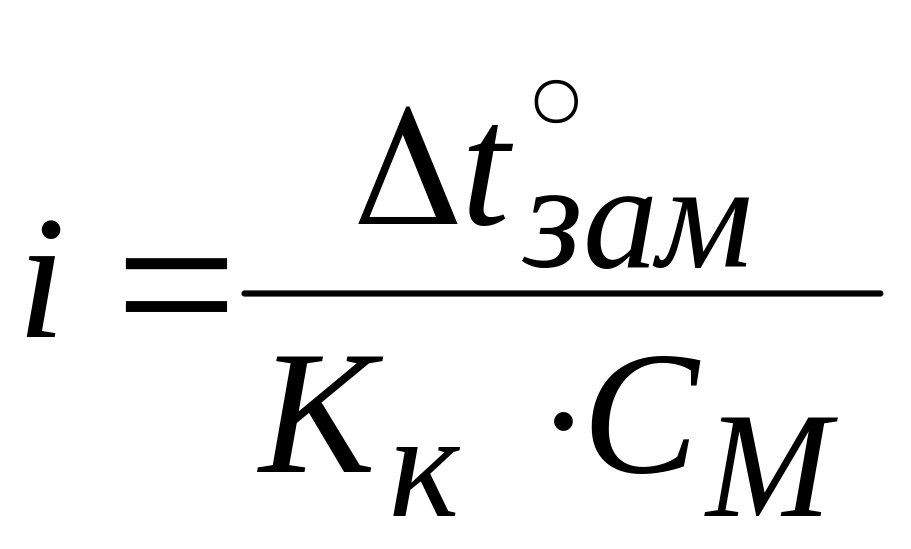
∆t°зам = 0°C – (-0,5°C) = 0,5°C
MKOH = 39 + 16 + 1 = 56 г/моль
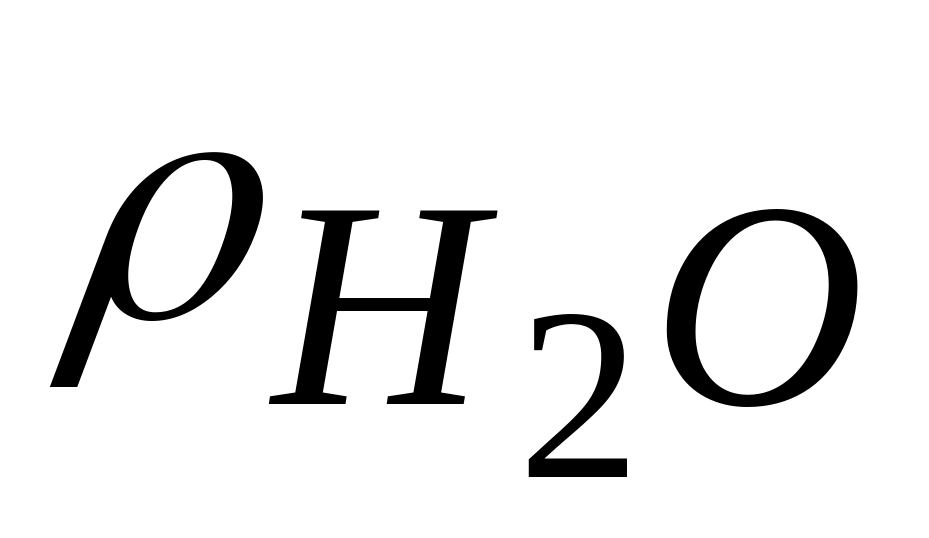 =
1 г/см3
, поэтому
mA
= 1 г/см3
·
500 см3
= = 500г
=
1 г/см3
, поэтому
mA
= 1 г/см3
·
500 см3
= = 500г
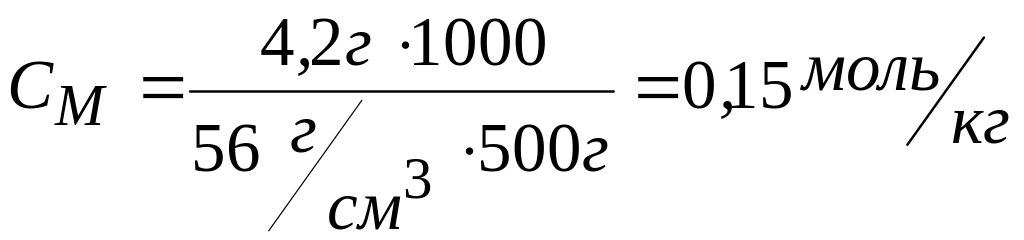
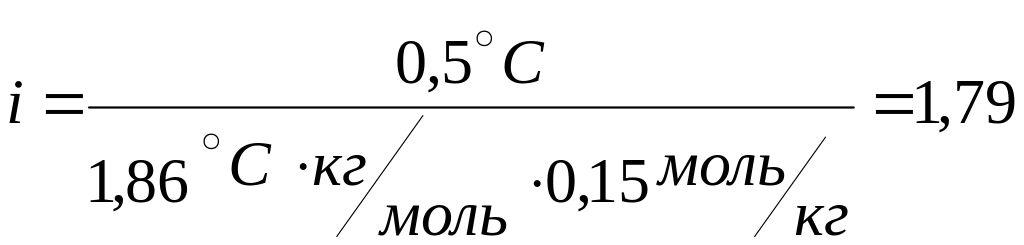
1<1,79<2
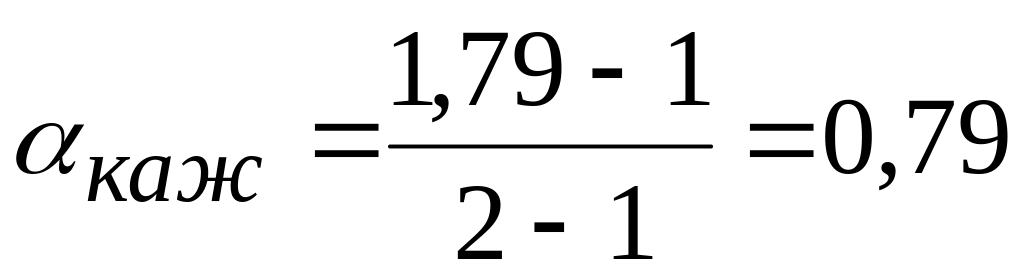 или
79%
или
79%
Ответ: кажущаяся степень диссоциации 0,79 или 79%.
Задача № 2
Определить степень диссоциации уксусной кислоты в 0,5 М растворе.
-
Дано:
СВ = 0,5 М = 0,5 моль/дм3
------------------------------
α - ?
Решение:
СН3СООН – слабая кислота
Для слабых электролитов
В приложении 3 находим значение константы диссоциации для уксусной кислоты
КД = 1,74 · 10─5

Ответ: степень диссоциации 5,9 · 10─3.
Задача № 3
Выпадет ли осадок, если смешать 3 см3 0,000005 М раствора серной кислоты и 4 см3 0,00002 М раствора хлорида бария.
Решение:
H2SO4 + BaCl2 = BaSO4 ↓ + 2HCl
3 см3 + 4 см3 = 7 см3
Осадок выпадет в том случае, если концентрация получившегося в ходе реакции сульфата бария больше, чем в насыщенном растворе.
BaSO4 →Ba2+ +
![]() ,т.к.
,т.к.
![]()
ПРтаб = 1,1 · 10─10 (значение взято в приложении 4)
![]() =
1,1 ·
10─10
=
1,1 ·
10─10
![]() =
1,05 ·
10─5
моль/дм3
=
1,05 ·
10─5
моль/дм3
Найдем концентрации ионов бария и сульфат – ионов. Ионы бария содержатся в 4 см3 0,00002 М раствора хлорида бария, при добавлении 3 см3 0,000005 М раствора серной кислоты объем стал равен 7 см3 и концентрация ионов бария
![]()
Концентрацию сульфат – ионов находим аналогично
![]()
т.
к.
![]() <СВ
(насыщ)
= 1,05 ·
10─5
М осадок не выпадет.
<СВ
(насыщ)
= 1,05 ·
10─5
М осадок не выпадет.
Ответ: осадок не выпадет
Задача № 4
В каком объеме может быть растворено 3 г иодида свинца (II).
Решение:
Чтобы найти объем насыщенного раствора PbI2, в котором содержится 3 г соли, надо знать концентрацию насыщенного раствора.
PbI2 → Pb2+ + 2I─
CB(насыщ) CB(насыщ) 2CB(насыщ)
![]()
ПРтаб = 1,1 · 10─9 (значение взято в приложении 4)
4![]() = 1,1 ·
10─9
= 1,1 ·
10─9
= 6,5 · 10─4 моль/дм3
![]() ,
,
![]()
![]()
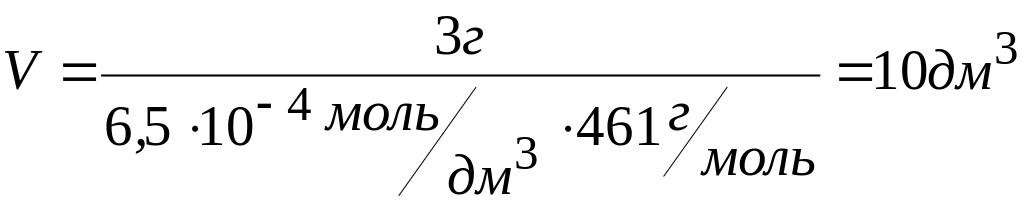
Ответ: 3 г иодида свинца можно растворить в 10 дм3 раствора.
Задача № 5
Степень диссоциации 0,1 Н раствора карбоната натрия при 0°С равна 70%. Вычислить осмотическое давление раствора.
Дано: Решение:
Na2CO3 По закону Вант-Гоффа
CЭ = 0,1 H
t º= 0ºC Росм = i · CB · R · T
αкаж = 70% = 0,7 R = 8,314 Дж/моль∙ К (универсальная газовая постоянная)
 T
= t°
+ 273 = 0 + 273 = 273 K
T
= t°
+ 273 = 0 + 273 = 273 K
Росм - ? СВ – молярная концентрация раствора, а в
условиях задачи дана нормальная концентрация, поэтому необходимо выполнить следующий расчет.
,
а
![]() ,
поэтому
,
поэтому
СВ
·
МВ
= СЭ
·
МЭ,
а
![]()
Найдем молярную и эквивалентную массу карбоната натрия
![]()
![]() ,
где
,
где
1 – валентность натрия; 2 – число атомов натрия в молекуле соли.
Тогда
![]()
Зная степень диссоциации, можно найти изотонический коэффициент
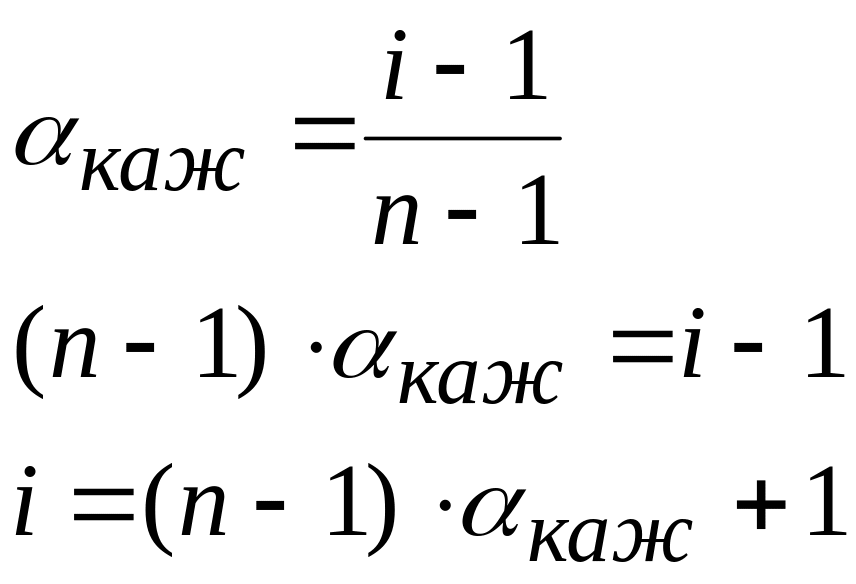
Из
уравнение диссоциации соли Na2CO3
→ 2Na+
+
![]() видно, что молекула образована тремя
ионами (2 иона натрия и 1 карбонат - ион),
поэтому
видно, что молекула образована тремя
ионами (2 иона натрия и 1 карбонат - ион),
поэтому
i = (3 – 1) · 0,7 + 1 =2,4
Подставляем полученные данные в формулу зависимости осмотического давления
Росм = 2,4 · 0,05 · 8,314 · 273 = 272,4 кПа
Ответ: осмотическое давление 272,4 кПа.
