
Ответы на Экзаменационные вопросы - 2005 год
.doc|
№ 1.1 Квантово-механическая модель атома. Характеристики энергетического состояния электрона системой квантовых чисел. Основное и возбужденное состояние атома.
Атом обладает минимальной энергией, когда все электроны расположены на первых от ядра орбитах. Такое состояние называется основным состоянием атома. Принцип минимальной энергии гласит, что электроны в основном состоянии заполняют орбиталь в порядке повышения уровня энергии орбитали. При получении порции энергии внутренние электроны могут переходить на внешние орбиты, такое состояние называется возбужденным, оно характеризуется неустойчивостью. Для характеристики поведения электрона в атоме введены четыре квантовых числа. Каждая орбита имеет номер, который называется главным квантовым числом и обозначается n. Оно определяет энергию (энергетический уровень) и размер электронных орбит. Орбитальное квантовое число l определяет форму атомной орбиты. Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве. Магнитное квантовое число изменяется в интервале [-l,l], включая ноль. Все вышеперечисленные квантовые числа принимают только целые значения. Чем сложнее форма атомной орбиты, тем большим числом способов она может быть ориентирована. Четвертое квантовое число называется спин ms. Каждый электрон имеет собственный механический момент движения, в зависимости от направления вращения, проекция спина на соответствующую ось координат имеет значение -½ или +½ . Четыре квантовых числа полностью характеризуют состояние электрона в атоме. |
№ 1.2 Периодический закон и периодическая система Д. И. Менделеева в свете квантово-механической теории строения атомов; s-, р-, d-, f-блоки элементов.
Свойства химических элементов находятся в периодической зависимости от заряда ядра атомов элементов. Выводы из переодического закона: 1. Строение внешней электронной оболочки атома является периодической функцией зарядового числа атома Z 2. Химические свойства элементов находятся в периодической зависимости от заряда ядра 3. Номер периода в системе элементов равен главному квантовому числу n энергетического уровня внешних n-орбиталей, заполняемых в этом периоде 4. Число элементов в периоде, т.е. его длина, равно удвоенному числу внешних квантовых орбиталей, заполняемых в этом периоде 5. В одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атома. Элемент – совокупность атомов с одинаковым зарядом ядра Однотипные соединения элементов – соединения сходные по химическому составу и структуре. Электроотрицательность – величина, характеризующая способность атомов этого элемента в молекулах притягивать к себе электроны. Сродство атома элемента к электрону – величина, измеряемая энтальпией реакции образования аниона s–блок – 1А – щелочные и 2А – щелочно-земельные металлы. В качестве валентных выступают е s-орбиталей (s-элементы) d-блок – 3Б–8Б, 1Б, 2Б. Комплексообразующие переходные элементы. Валентные – e s- и d-орбиталей (d-элементы) p-блок – 3А–8А – неметаллы, амфотерные и благородные элементы. Валентные e p-орбиталей (p-элементы) |
№ 1.3 Развитие представлений о природе химической связи. Основные характеристики связи. Геометрия связи и молекулы. Водородная связь. Межмолекулярные взаимодействия.
Химическая связь – совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов. Основные характеристики хим. связей: Длина связи - rс величина, измеряемая расстоянием между ядрами связываемых атомов Прочность связи Ec – величина, измеряемая энтальпией ΔНс образования связи. Ориентация химической связи αс – величина, измеряемая углом, между направлениями связей данного атома с соседними атомами молекулы. αс – валентный угол. Полярность связи – μс величина, измеряемая электрическим моментом данной связи Водородная связь – образуется, если положительно заряженный атом H одной молекулы притягивается к отрицательно заряженному атому другой молекулы. Это притяжение имеет частично электростатический (кулоновский), частично ковалентный характер. Между молекулами существует: дипольное взаимодействие, индуцированное или дисперсионное взаимодействие (вандер-ваальсовое взаимодействие) – возникновение сил притяжения и отталкивания при возникновении и исчезновении частичных зарядов внутри молекулы, порождающие заряды на соседних молекулах. |
|
|
|
|
|
№ 2.1 Классификация веществ живого организма по их биологической роли. Классификация реакций, основанная на природе переносимых частиц.
Аминокислоты – амфотерные органические соединения, содержащие кислотную, карбоксильную и аминогруппу. Белки – полипептиды(полиамиды , состоящие из α – аминок-т) с большим молекулярным весом. Углеводы – (сахара),используются как источники энергии в процессах метаболизма, являются компонентами ряда классов веществ клетки, включая нуклеин. к-ты и др. Липиды – органические соединения, входящие в состав тканей и животных растений, построены по типу сложных эфиров. Нейтральные жиры и жироподобные соединения. Гормоны – физиологически активные в-ва, которые вырабатываются эндокринными органами в ответ на сигналы из внешней или внутренней среды. Витамины – группа органических соединений разнообразной химической природы, необходимых для нормальной жизнедеят-ти организма. Ферменты – специфические белки, образующиеся в тканях организмов, обладающих способностью ускорять химические реакции. Изменение химической природы реагирующих веществ в ходе химической реакции происходит в результате перераспределения электронов внешних оболочек атомов, т. е. за счет переноса частиц от одного реагента к другому. Такие частицы могут быть простейшими (электрон, протон) или более сложными (атомно-молекулярными). В соответствии с видом переносимых частиц рассматривают следующие основные типы реакций в растворах: 1) протолитические реакции, суть которых заключается в переносе протона от одних частиц к другим; изменение кислотно –основных св-в реагирующих веществ. Кислота –донор протонов, основание – акцептор протонов. Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями – протолитические. 2) редокс-реакции, в ходе которых от одной частицы к другой переносятся электроны, что вызывает изменение окислительно-восстановительных свойств реагирующих веществ; 3) реакции замещения лигандов, сопровождающиеся переносом электронных пар и приводящие к образованию или разрушению комплексных соединений; 4) гетерогенные реакции в растворах электролитов, т. е. реакции образования осадков или их растворения. |
№ 2.2 Протолитические реакции. Основные положения протолитической теории кислот и оснований: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара, амфолиты. Водородный показатель рН.
К протеолитическим реакциям относятся: 1) Процессы ионизации кислот и оснований: CH3COOH + H2O CH3COO- + H3O+ NH3 + H2O NH4+ + OH- c(B-)c(H3O+) с(OH-)c(HB+) Ka = c(HB) Kb = c(B) Для удобства расчётов и записи часто пользуются не самими константами, а их показателями, т.е. pKa = - lgKa; pKb = - lgKb 2) Реакции нейтрализации между двумя слабыми электролитами (CH3COOH и NH3): NH3 + CH3COOH NH4+ + CH3COO- сильными и слабыми электролитами: NH3 + H3O+ NH4+ + H2O CH3COOH + OH- H2O + CH3COO- и сильными электролитами H3O+ + OH- H2O + H2O 3) ионный гидролиз CH3COO- + H2O CH3COOH + OH- Kw Kh(CH3COO-) = Ka(CH3COOH)
NH4+ + H2O H3O+ + NH3 Kw Kh(NH4+) = Kb(NH3) Для характеристики кислотности среды вводят водородный показатель pH. pH = -lgc(HB) [(HB) = (H3O+)] – для сильных кислот pH = 14 + lgc(B) – для сильных оснований pH = 0,5 (pKa + lgc(HB))- раствор слабой кислоты pH = 14 – 0,5(pKb + lgc(B)) – раствор слабого основания
|
№ 2.3 Окислительно-восстановительные реакции. Редокс-системы первого и второго типа. Типы редокс-реакций: межмолекулярные, внутримолекулярные, диспропорционирования.
ОВР - химические процессы, сопровождающиеся переносом электронов от одних молекул к другим, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ Окисление – потеря e Восстановление – присоединение е Восстановители (Red) – отдают e. Малую СО. ОЭО<1,5 Окислители (Ox) – присоединяют е. Большая СО. ОЭО>3.0 Степень окисления (СО) – формальный заряд атома.
Редокс-системы второго типа, в которых перенос e сопровождается переносом Н+. В них наблюдается совмещённое редокс-протолитическое равновесие. Для расчёта их RT a(Ox) редокс-потенциала: φ = φ0 + nF ln a(Red) am(H+) RT a(Ox) φ = φ0 + nF ln a(Red) уравнение Нернста для редокс-потенциала (когда и окислитель и восстановитель находятся в растворённом состоянии). RT φ = φ0 + nF ln ai – уравнение Нернста для электродного потенциала (на границе раздела металл-раствор) Межмолекулярные редокс-реакции. Атом-окислитель и атом-восстановитель находятся в составе разных реагентов 2KNO2 + 2KI + 2H2SO4 2NO + I2 + 2K2SO4 + 2H2O Диспропорционирования – одна часть атомов одного и того же вещества выступает в роли окислителя, а друга (в той же степени окисления) – в роли восстановителя 2NO2 + 2OH- NO2- + NO3- + H2O Внутримлекулярного окисления-восстановления - атом-окислитель и атом-восстановитель находятся в составе одной формульной единице: 2KClO3 3O2 + 2KCl |
|
|
|
|
|
№ 2.4 Лигандообменные реакции. Основные понятия координационной теории Вернера. Пространственное строение комплексных соединений. Классы комплексных соединений: хелатные, внутрикомплексные, макроциклические, многоядерные, сэндвичевые и др.
Mz+ + nLx- [MLn]z-nx – образование ковалентной связи по донорно-акцепторному механизму. Тероия Вернера (1893г) – В молекулах комплексных соединений выделяют центральный атом или ион М и связанные с ним n-молекул (или ионов) L - лигандов Центральный атом, окружающие линганды – внутренняя координационная сфера MLn z-nx – внешняя сфера комплекса Центральный атом координирует лиганды, геометрически правильно располагая их в пространстве. Число (n) лигандов называют координационным числом, а внутреннюю сферу - координационной Ориентация связей металл-лиганд определяет пространственную конфигурацию комплексных молекул и ионов. Бывают квадратные (ML4), октаэдрические (ML6), линейные (ML2), Классы комплексных соединений: макроциклические (донорные атомы связаны в кольцо), полидентатные (несколько донорных атомов), хелатные (полидентатные лиганды, координируемые одним и тем же центральным атомом), монодентатные (одна связь с центральным атомом) с([MLn]z-nc) c(Mz+)cn(Lx-) β = c(Mz+)cn(Lx-) (константа устойчивости) Kн = с([MLn]z-nc) (константа нестойкости) |
№ 2.5 Реакции атомно-молекулярного обмена. Реакции радикального, электрофильного и нуклеофильного замещения.
Радикальное замещение (галогенирование) – состоит из стадий: инициирование, рост цепи, обрыв цепи. Это типичные реакции фотолиза. Характерны для насыщенных органических соединений Электрофильное замещение – характерно для циклических соединений. Вначале происходит образование нестойкого π-комплекса, а затем устойчивого σ-комплекса.. Затем происходит отщепление протона от σ-комплекса и восстанавливается ароматичность. Нуклиофильное замещение – атакующий реагент (нуклеофил) отдаёт субстрату свою пару электронов, за счёт которой образуется связь между субстратом и нуклеофилом, а хорошо уходящая группа (нуклеофуг) отщепляется со своей парой электронов. Характерны для насыщенных органических соединений включающих различные функциональные группы. Продуктами таких реакций, в зависимости от количества и расположения атомов галогена в гало-генопроизводном, могут быть спирты, карбонильные соединения, а также карбоновые кислоты, например:
. |
№ 2.6 Реакции ассоциации-диссоциадии и агрегации. Реакции присоединения, осаждения.
Диссоциативные (мономолекулярные) – процесс распада молекулы на отдельные части. Участвует одна молекула. Ассоциативные (бимолекулярные) – нуклеофильная реакция и согласованная реакция Агрегация – укрепление дисперсных частиц коллоидной системы. Постепенно они становятся настолько большими, что особенности присущие коллоидным системам исчезают. Реакции осаждения – идут с выпадением осадков. Химические
реакции осаждения подразделяются на
две группы:
1. реакции
присоединения,
например взаимодействие аммиака и
фосфорной кислоты с образованием
моноаммонийфосфата
или
пероксида водорода и метабората
натрия с образованием пербората
натрия
2.
реакции
обменного разложения,
когда один из вновь образующихся
компонентов является менее растворимым
по сравнению с другим, и высаливается
из раствора, например
Вторая группа реакций получила более широкое распространение |
|
|
||
|
|
||
|
№ 3.1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
Термодинамика – наука о взаимопревращениях теплоты и энергии. Термодинамический метод основан на ряде понятий: термодинамическая система – любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделённый от других объектов природы Процессы жизнедеятельности на Земле обусловлены накоплением солнечной энергии в биогенных веществах – белках, жирах, углеводах и последующим превращением этих веществ в живых организмах с выделением энергии. С развитием термодинамики стало возможным количественно рассчитывать превращение энергии в биохимических реакциях и предсказывать их направление. Химическая термодинамика изучает превращения энергии и энергетические эффекты, сопровождающие химические и физические процессы, а также возможность и направление самопроизвольного протекания процесса. Химическая термодинамика является основой современной химии. Химическая реакция - процесс, при котором одни связи заменяются другими, образуются одни соединения, разлагаются другие. Следствие - энергетические эффекты, т.е. изменение внутренней энергии системы. Система - ело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее (вода в стакане). Если такая система не обменивается веществом со средой (стакан покрыт крышкой), она называется закрытой. Если же система имеет постоянный объем и рассматривается как лишенная возможности обмена веществом и энергией с окружающей средой (вода в термосе), такая система называется изолированной. Внутренняя энергия U - общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и. д., т.е. все виды энергии кроме кинетической и потенциальной энергии системы в целом. |
№ 3.2 Основные понятия термодинамики. Внутренняя энергия. Работа и теплота - две формы передачи энергии. Типы термодинамических систем и процессов.
Понятия термодинамики: Система – любой объект природы, состоящий из большого числа молекул (структурных единиц) и отделённый от других объектов природы реальной или воображаемой граничной поверхностью (границей раздела). Состояние системы – совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики. Внутренняя энергия системы – сумма энергий теплового движения молекул и энергии взаимодействия между ними или функция состояния системы, приращение которой равно теплоте Qv. полученной системойв изохорном процессе. Внутреннюю энергию нельзя определить, поскольку у системы нельзя отнять всю энергию. Фаза - гомогенная часть гетерогенной системы (вода и лед в стакане) Фазовый переход - превращения фаз (таяние льда, кипение воды). Термодинамические функции: состояния системы: применяются для определения изменения энергии в тех или иных условиях.(например ΔЕ – внутренняя энергия системы) Изменение ΔЕ обусловлено работой W, которая совершается при взаимодействии системы со средой, и передачей теплоты Q между средой и системой. Типы ТД систем (по характру обмена веществом и энергией с окружающей средой) Изолированная система – не обменивается со средой ни веществом, ни энергией (Δm = 0; ΔE = 0) Закрытая система – не обменивается со средой как веществом, но может обмениваться энергией Открытая система – может обмениваться со средой как веществом, так и энергией. (по агрегатному состаянию) Гомогенная – отсутствие резких изменений физических и химических свойств при переходе от одних областей системы к другим. Гетерогенная – две или более гомогенные системы в одной. Теплота образования - тепловой эффект реакции образования вещества из каких-либо исходных веществ. Энергетические превращения в ходе процесса выражаются в виде теплового эффекта - либо теплота выделяется (экзотермические реакции), либо поглощается (эндотермические реакции). Количество выделенной или поглощенной теплоты Q называется тепловым эффектом реакции.Изучением тепловых эффектов занимается термохимия. |
№ 3.3 Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования, стандартная энтальпия сгорания. Закон Гесса. Термохимические процессы. Применение первого начала термодинамики к биосистемам.
Первое начало термодинамики: Приращение внутренней энергии системы ΔE в некотором процессе равно теплоте Q, полученной системой, плюс работа W, совершённая над системой в этом процессе. ΔE = Q + W Энтальпия: функция состояния системы, приращение которой равно теплоте, полученной системой в изобарном процессе. Н = E + pV Стандартная энтальпия образования вещества (ΔfH0) – увеличение или уменьшение энтальпии, сопровождающее образование 1 моль вещества из простых веществ, при условии, что все участники реакции находятся в стандартном состоянии Стандартная энтальпия сгорания вещества (ΔсH0) – уменьшение энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления. Закон Гесса – энергия не создаётся и не уничтожается, а лишь переходит из одного вида энергии в другой. Следствия из закона Гесса 1) Тепловой эффект кругового процесса равен нулю. Круговой процесс - система, выйдя из начального состояния, в него же и возвращается. DH1 + DH2 - DH3 = 0 Отсюдаа же вытекает и закон Лавуазье-Лапласа. 2) Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования начальных (исходных) веществ. 3) Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных продуктов. Термохимические процессы: Экзотермические – реакции, при протекании которых происходит уменьшение энтальпии системы (ΔН < 0) и во внешнюю среду выделяется теплота Эндотермические – реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту Q извне. -ΔE = -Q – W – в биологических системах, т.к работа совершается системой за счёт убыли внутренней энергии, теплота отдаётся во внешнюю среду. |
|
|
||
|
№ 3.4 Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия. Энергия Гиббса. Химический потенциал. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Термодинамические условия равновесия. Роль энтальпийного и энтропийного факторов. Стандартная энергия Гиббса образования, стандартная энергия Гиббса биологического окисления. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.
Второе начало термодинамики: В изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут протекать только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG < 0). В состоянии равновесия G = const, G = 0 Обратимый процесс – если при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными Необратимый процесс – если хоть одно из промежуточных состояний неравновесное. Энтропия – энтропия – функция состояния, приращение которой ΔS равно теплоте Qмин подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру T, три которой осуществляется процесс: ΔS = Qмин/ T или мера вероятности пребывания системы в данном состоянии – мера неупорядоченности системы. Энергия Гиббса – функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах. G = H – TS ΔG = ΔH – TΔS cd(D)ce(E) ΔrG = ΔrG0 + RTln ca(A)cb(B) – изотерма Вант-Гоффа Химический потенциал вещества Х в данной системе – величина, которая определяется энергией Гиббса, приходящейся на моль этого G (X) вещества. μ(X) = n (X) Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем) В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG = 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (TΔrS) фактором. Для реакций, у которых ΔrH < 0 и ΔrS > 0, энергия Гиббса всегда будет убывать, т.е. ΔrG < 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS = 0 Стандартная энергия Гиббса: ΔrG = ΣυjΔjG0j – ΣυiΔiG0i Экзерогонические реакции – G < 0 и системой совершается работа (окисление глюкозы) Эндерогонические – G > 0 и над системой совершается работа. Энергетическое сопряжение. В сопряженной системе определяющим фактором будет сумма разностей потенциалов двух процессов (ΔРЭФФ = ΔP1 + ΔP2). Суммарный процесс возможен при условии, если ΔРЭФФ — величина отрицательная. Благодаря энергетическому сопряжению возможно взаимопревращение одних форм работы и энергии в другие |
№ 3.5 Химическое равновесие. Обратимые и необратимые по направлению реакции. Константа химического равновесия. Уравнения изотермы и изобары химической реакции. Прогнозирование смещения химического равновесия. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма.
Обратимые по направлению химические реакции – реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлениях Константа химического равновесия – для обратимой реакции общего вида aA + bB pP + qQ при постоянных внешних условиях в равновесии отношение произведений концентраций продуктов к произведению концентрации реагентов есть величина постоянная, не зависящая от химического состава системы [P]p [Q]q Kc = [A]a [B]b = const при p, T = const Уравнение изотермы химической реакции: ΔGр-я = RTln(Πc/Kc) Уравнение изобары химической реакции K2 ΔrH ln K1 = R ((1/T1) – (1/T2)) Прогнозирование смещения химического равновесия. С помощью уравнения изотермы можно рассчитать G реакции при заданном значении Πc, если известна Kc реакции. И наоборот, если известна G реакции при заданном Πc, то можно рассчитать Kc. Гомеостаз - относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими. Учение о гомеостазе - это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни. Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот. В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток. Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов - от морфологически самых простых до наиболее сложных - выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели - сохранению постоянства внутренней среды. |
№ 4.1 Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя. Автопротолиз воды. Константа автопротолиза воды. Зависимость растворимости веществ в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость. Термодинамика растворения. Диффузия. Понятие об идеальном растворе.
Важнейшие биологические жидкости организма человека – растворы белков, солей, углеводов и липидов в воде. Вода хорошо растворяет ионы и многие полярные соединения. Диэлектрическая проницаемость воды обуславливает это свойство (ε = 78,5). Притяжение между ионами уменьшается примерно в 80 раз при растворении в воде. Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. КН2О -константа автопротолиза воды КН2О = (Н3О+)(ОН-) Константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25°С константа автопротолиза воды = 10–14 моль2/л2. При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения. Термодинамика процесса растворения ΔG = (ΔH – TΔS) < 0. ΔH – энтальпийный фактор, TΔS – энтропийный фактор. При растворении жидких и твёрдых веществ энтропия системы обычно возрастает (ΔS>0), т.к. растворяемые вещества из более упорядоченного переходят в менее упорядоченное. Вклад энтропийного фактора, особенно заметен при повышенных Т, т.к. произведение TΔS – велико, в результате возрастает убыль ΔG. При растворении газов ΔS<0, т.к. вещество из менее упорядоченного переходит в более упорядоченное, а снижение T способствует растворению газов. Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе. Закон Фикка: скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества. Δn Δc Δt = -DS Δx Идеальный раствор – раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом. |
|
|
||
|
|
||
|
№ 4.2 Коллигативные свойства разбавленных растворов электро литов. Закон Рауля и следствия из него: понижение температуры замерзания раствора, повышение температуры кипения раствора, осмос. Осмотическое давление: закон Вант-Гоффа.
Коллегативные свойства растворов: Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором нелетучего электролита равно молярной доле растворённого вещества. Следствие: Давление пара раствора, содержащего нелетучее растворённое вещество, прямо пропорционально молярной доле растворителя: р = Kpx(X1) Повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора. (ΔTкип = Кэb(X); ΔTкип = Кзb(X)) Осмос – диффузия молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией. Остмотическое давление – величина измеряемая минимальным гидравлическим давлением , которое нужно приложить к раствору, чтобы осмос прекратился. Закон Ват-Гоффа π = с(Х)RT (расчет давления) |
№ 4.3 Элементы теории растворов электролитов. Сильные и слабые электролиты. Константа ионизации слабого электролита. Закон разбавления Оствальда. Общие положения теории Дебая-Хюккеля. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме. Осмотические свойства растворов электролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов. Гипо -, гипер- и изотонические растворы. Изотонический коэффициент. Понятие об изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и цитолиз.
Электролиты, которые практически полностью диссациируют на ионы – сильные Электролиты, которые не полностью ионизируются – слабые Степенью диссоциации электролита называется отношение числа молекул, распавшихся на ионы, к общему числу его молекул, введённых в раствор. Закон Освальда: степень диссоциации слабого электролита возрастает с разбавлением раствора αи2с(Х) Кд = 1 – αи Теория Дебая – Хюккеля. Основная ее идея - вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку. Тормозящее действие ионной атмосферы на передвижение ионов проявляется таким образом, что все свойства, зависящие от концентрации ионов (такие, как электрическая проводимость, осмотическое давление и т.д.), отвечают заниженной степени диссоциации – кажущейся степени диссоциации. Для оценки состояния ионов в растворе пользуются понятием активности иона – его условной концентрации, соответственно которой он действует при химических реакциях: a = fC, где a – активность иона, C – его концентрация, f – коэффициент активности. Значение f < 1 указывает на связывающее взаимодействие ионов; если f близок к единице, это говорит о слабом межионном взаимодействии. В очень разбавленных растворах действие межионных сил почти не проявляется. Ионная сила раствора – величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда. I = ½ (c(X1)z12 + c(X2)z22 + … + c(Xn)zn2) Активность электролита – эффективная концентрация в соответствии с которой он участвует в различных процессах В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы. Биологические жидкости и ткани содержат множество различных электролитов: NaCL, KCl, HCl, CaCl2, NaH2PO4, NaHCO3 и др. Устойчивость биологических ВМС и скорость многих биохимических реакций в значительной мере зависят от природы и концентрации присутствующих в жидкостях и тканях ионов. Осмолярность (осмоляльность) – активная концентрация частиц, не проникающих через идеальную полупроницаемую мембрану. Для разбавленных растворов их численные значения совпадают. Это эмпирические величины, использование которых позволяет учесть разные по характеру отклонения от з-на Рауля, возникающие в случае неидеальных растворов. Гипертонический раствор – с большим осмотическим давлением, гипотонический – с меньшим. Такое деление имеет смысл только при сравнении одного раствора с другим. Изотонический коэффициент (i) – показывает степень отклонения коллегативных свойств растворов электролитов от растворов нелетучих неэлектролитов pосм = icRT Изоосмия - относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д. Это одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции (гомеостаза) Плазмолиз - отставание протопласта от оболочки при погружении клетки в гипертонический раствор. Характерен для растительных клеток. Животные клетки сжимаются. Цитолиз - разрушение животных и растительных клеток, выражающееся в полном или частичном их растворении |
№ 5.1 Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции, истинная скорость. Классификация реакций, применяющихся в кинетике: реакции гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения.
Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций. Последовательность и характер стадий химических реакций называют механизмом реакции. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных соединений. В элементарном акте принимает участие одна или две частицы (описаны единичные случаи одновременного взаимодействия трех частиц). Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Различают следующие типы сложных реакций: параллельные, последовательные, сопряженные, цепные. Для параллельных реакций характерно протекание нескольких процессов с участием одних и тех же исходных веществ. Эти процессы завершаются образованием разных продуктов реакции. Скорость параллельных реакций определяется наиболее быстрой стадией. В последовательных реакциях образование конечного продукта реакции из исходных веществ происходит не непосредственно, а через ряд промежуточных продуктов. Скорость последовательной реакции определяется наиболее медленной стадией, которая называется лимитирующей. Некоторые сложные реакции состоят как из последовательных, так и параллельных реакций.
Скорость
химической реакции
(v)
определяется изменением концентрации
Ас реагирующих веществ (или продуктов
реакции) в единицу времени.
Размерность скорости химической
реакции — концентрация/время:
Скорость
химической реакции в общем случае не
является постоянной в течение
всего времени ее протекания. Рассмотрим
обратимую реакцию:
Скорость
прямой реакции
(образование веществ D
и F)
уменьшается по мере расходования
исходных веществ (А и В), а скорость
обратной реакции будет увеличиваться
по мере накопления продуктов реакции
(D
и F).
В связи с этим в химической кинетике
пользуются понятием средней
скорости
в данном интервале времени Δt:
Истинная
скорость
(в любой момент времени) определяется
первой производной концентрации по
времени: Скорость химической реакции зависит в первую очередь от природы реагирующих веществ. Скорость гомогенной реакции зависит от концентрации реагентов, а гетерогенных — от площади соприкасающихся фаз, т. е. степени дисперсности. Скорости всех реакций зависят от температуры, многих реакций — от присутствия катализаторов. Важной характеристикой реакции является период полупревращения t0 5 — время, за которое в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада. Порядок реакции определяют, сопоставляя изменение величин начальной концентрации (с0) и периода полупревращения (t0,5). Реакции, для которых наблюдается прямая зависимость между изменениями значений с0 и t0>5, относятся к реакциям нулевого порядка; ре-акции с обратной зависимостью величин с0 и t05 — к реакциям второго порядка; реакции, в которых tO,5*f{ca) — к реакциям первого порядка. |
|
|
||
|
|
||
|
№ 5.2 Зависимость скорости реакции от концентрации. Кинетические уравнения реакций нулевого, первого и второго порядков. Экспериментальные методы определения скорости и константы скорости реакций.
Скорость
химической реакции
(v)
определяется изменением концентрации
Ас реагирующих веществ (или продуктов
реакции) в единицу времени.
Размерность скорости химической
реакции — концентрация/время:
Скорость
химической реакции в общем случае не
является постоянной в течение
всего времени ее протекания. Рассмотрим
обратимую реакцию:
Скорость
прямой реакции
(образование веществ D
и F)
уменьшается по мере расходования
исходных веществ (А и В), а скорость
обратной реакции будет увеличиваться
по мере накопления продуктов реакции
(D
и F).
В связи с этим в химической кинетике
пользуются понятием средней
скорости
в данном интервале времени Δt:
Истинная
скорость
(в любой момент времени) определяется
первой производной концентрации по
времени:
Зависимость
скорости химической реакции от
концентрации
описывается кинетическим уравнением.
Например, для реакции: Константа скорости зависит от тех же факторов, что и скорость химической реакции, но не зависит от концентрации реагирующих веществ. Величина p + q определяет порядок кинетического уравнения реакции, который показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0, 1, 2 и более, он может быть также дробным. Кинетические уравнения.
О
Д - единица измерения — секунда в минус первой степени.
Для
реакций второго порядка:
|
№ 5.3 Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции: энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния.
Скорость
реакций зависит от температуры.
В соответствии с эмпирическим правилом
Вант-Гоффа скорость большинства
реакций увеличивается приблизительно
в 2—4 раза при увеличении температуры
на 10°С: Многие каталитические реакции не подчиняются этому правилу, для большинства из них у < 2. Почти все биохимические реакции осуществимы только в присутствии ферментов, следовательно, почти все они не подчиняются данному правилу. Кроме того, при увеличении температуры свыше определенного значения (45—50°С) биохимические реакции резко замедляются, а затем останавливаются, что связано с инактивацией ферментов при высоких температурах.
Более
точную зависимость скорости химической
реакции от температуры устанавливает
уравнение Аррениуса:
Энергия активации реакции Ел — энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции.
У
г Согласно теории активных соударений химическая реакция происходит при каждом столкновении реагирующих частиц, соответствующим образом ориентированных относительно друг друга и обладающих энергией, равной (или больше) энергии активации. В теории активных соударений используются основные положения молекулярно-кинетической теории и предположения о существовании энергетического барьера, который должен быть преодолен в ходе химической реакции. В простейшем случае теория активных столкновений предполагает, что для осуществления реакции молекулы должны сблизиться на расстояние, равное полусумме их эффективных диаметров, учитывающих взаимодействие, при этом молекулы рассматриваются как жесткие сферы. Чтобы согласовать теоретическую зависимость (7.8) с экспериментальными данными, в уравнение вводят стерический фактор Р, который учитывает тот факт, что для осуществления реакции частицы в момент столкновения должны быть соответствующим образом ориентированы относительно друг друга. По этой причине выражение константы скорости записывают следующим образом:
Доказательство в теории переходного состояния того факта, что скорость реакции зависит не только от энергии активации, но и от энтропии активации, позволяет объяснить различие в скоростях реакций с близкими величинами энергии активации. Скорость будет выше у той реакции, энтропия активации которой больше. |
№ 5.4 Катализ. Гомогенный и гетерогенный катализ. Энергетический профиль каталитической реакции. Особенности каталитической активности ферментов. Уравнение Михаэлиса-Ментен и его анализ.
Катализом называют явление изменения скорости химической реакции под воздействием катализаторов. Реакции, протекающие с участием катализаторов, называют каталитическими. Гомогенный – это такой катализ, когда катализатор и все реагирующие вещества находятся в одной фазе. Гомогенный катализ в растворах наиболее часто вызывается действием водородных и гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом. Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряются действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость. Главным положением гомогенного катализа является представление о том, что в ходе реакции образуются неустойчивые промежуточные соединения катализатора с реагирующими веществами, которые затем распадаются с регенерацией катализатора К гомогенному катализу относятся многие реакции кислотно-основного взаимодействия, реакции комплексообразования, многочисленные реакции гидрирования, сульфидирования, реакции, катализированные ферментами. К гетерогенным относятся каталитические процессы, протекающие на границе раздела фаз Т-Г, Т-Ж. При гетерогенном катализе реакция протекает на поверхности катализатора. Поэтому площадь поверхностного слоя катализатора и его строение определяют активность катализатора. Гетерогенный катализ находит большее применение в промышленности, чем гомогенный. В качестве гетерогенных катализаторов используют переходные металлы, металлы первой группы, фосфорную кислоту. Чаще всего для анализа кинетических схем ферментативного катализа используют метод стационарных концентраций (k2 >> k1). Применение этого метода к простейшей схеме катализа дает уравнение Михаэлиса-Ментен:
Во многих случаях скорость реакции резко изменяется в присутствии специальных веществ - катализаторов. Катализаторы участвуют в реакции, но в результате ее не расходуются. Катализаторы биологических процессов, протекающих в живых организмах, представляют собой белковые молекулы, которые называют ферментами, или энзимами.
|
|
|
||
|
|
||
|
№ 6.1 Понятие биогенности химических элементов. Биосфера, круговорот биогенных элементов. Кларки элементов. Концентрирование биогенных элементов живыми системами. Классификация биогенных элементов по их функциональной роли: органогены, элементы электролитного фона, микроэлементы. Понятие о примесных элементах (аккумулирующихся и неаккумулирующихся). Основные источники поступления примесных элементов в организм человека. Химические аспекты окружающей среды.
Биогенные элементы – элементы, необходимые для построения и жизнедеятельности различных клеток и организмов. Биосфера – часть земной оболочки, занятая растительными и животными организмами. Среда, организованная определённым образом, переработанная живыми организмами и космическими излучениями и приспособленная к жизни (по В.И. Вернадскому) Кларки элементов - - числовые оценки средних содержаний химических элементов в земной коре, гидросфере, атмосфере, Земле в целом, различных типах горных пород, космических объектах и др. Кларк может быть выражен в единицах массы (%, г/т и др.) либо в атомных %. Термин "кларк" введен А.Е.Ферсманом, назван по имени Ф. У. Кларка. Биологическое концентрирование элемента – увеличенное содержание элемента в организме по сравнению с окружающей средой. Непропорциональное содержание элементов в организме и среде связано с тем, что усвоение элементов влияет растворимость их природных соединений в воде. Органогены – систем (C, Н, О, N, Р, S) только 6 элементов, составляющих основу живых. Они составляют в организме 97,4% Элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме. Микроэлементы – (I, Cu, As, F, Br, St, Ba, Co) их содержание в организме находится в пределах от 10-3 до 10-5 %. Примесные элементы - биологическая роль не выяснена до конца. Их делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). |
№ 6.2 Химия элементов s-блока. Электронные структуры атомов и катионов. Сравнение свойств ионов элементов IA- и ПА-групп (комплексообразование, образование осадков). Биологическая роль натрия, калия, кальция, магния. Химическое сходство и биологический антагонизм (натрий-калий, магний-кальций).
К блоку S-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Химические св-ва: s-элементы легко отдают валентные s-электроны, т.е. они представляют собой сильные восстановители. Они имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило они образуют соединения с ионным типом связи, исключение – водород, для него характерна ковалентная связь Биологическая роль Na – содержание в организме массой 70 кг – 60 г. (2610 ммоль) – 0,08%. Около 40% натрия, содержащегося в костной ткани, участвует в обменных процессах и благодаря этому, скелет является либо донором, либо акцептором ионов Na, что способствует поддержанию постоянства концентрации ионов Na во внеклеточной жидкости. Натрий является основным внеклеточным ионом. В организм человека находится натрий в виде его растворимых солей главным образом хлорида, фосфата и водородкарбоната. Биологическая роль К – содержание в организме массой 70 кг составляет примерно 160 г (4090ммоль) – 0,23%. 98% находится внутри клеток. Антагонист Na. Играет важную роль в сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, отдельных реакциях. Биологический антагонизм. Натрий-калиевый градиент обуславливает возникновение разности потенциалов на клеточной мембране. За счёт энергии гидролиз 1 молекулы АТФ три иона Na+ выводятся из клетки, два иона К+ поступают внутрь клетки, что и служит причиной возникновения разности потенциалов. Биологическая роль Mg: его соединения участвуют в формировании костей, в регуляции работы нервной ткани, обмене веществ. Ежедневно человеку требуется примерено 300 – 400 мг Mg. От концентрации ионов Mg2+ зависит устойчивость рибосом Биологическая роль Ca: в организме человека в среднем около 1 кг. кальция. Входит в состав костной ткани в форме ортофосфата. Много в молоке и молочных продуктах. При его недостатке назначают соль глюконата кальция. Биологический антагонизм: наблюдается при сокращении мышцы. Ионы Ca2+ принимают участие в сокращении мышцы, а ионы Mg2+ принимают участие в расслаблении мышцы. Также, при длительном поступлении в организм избыточных количеств солей Mg наблюдается усиленное выделения Ca из костной ткани |
№ 6.3 Химия элементов d-блока. Электронные структуры атомов и катионов. Наиболее важные биогенные элементы d-блока: остров биометаллов хром-медь, молибден. Окислительно-восстановительные свойства: закономерности устойчивости степеней окисления, неустойчивость некоторых степеней окисления из-за реакции соединений с водой (кобальт +3, хром +2): диспропорционирование промежуточных степеней окисления (марганец +3, +6). Устойчивость в условиях организма степени окисления. Образование комплексных соединений с органическими лигандами; гидроксокомплексы; амминокомплексы; образование нерастворимых соединений: гидроксиды, фосфаты, карбонаты, оксалаты.
К блоку d-элементов относятся 32 элемента периодической системы. У d-элементов – непропорционально медленное возрастание атомного радиуса с возрастанием числа электронов. В результате наблюдается незначительное изменение атомных и химических свойств d-элементов с увеличением атомного номера. Есть переменная валентность и разнообразие степеней окисления. Это связано с незавершённостью предвнешнего d-электронного слоя. С увеличением атомного номера в группах металлические свойства закономерно уменьшаются. В промежуточной степени окисления проявляют амфотерные свойства. Изменение окислительно-восстановительных свойств: В периоде с увеличением заряда ядра наблюдается уменьшение устойчивости соединений элементов в высших степенях окисления. Параллельно возрастают окислительно-восстановительные потенциалы этих соединений. Комплексные соединения – усложненные группировки атомов, состоящие из типичных групп атомов, которые в определенной степени сохраняют свою индивидуальность, но и взаимодействуют между собой. Однородные комплексы – соединения, где все лиганды являются частицами одного вида. Неоднородные комплексы – присутствуют лиганды разных типов. Наиболее прочные комплексы образуют d - элементы. Для жизнедеят-ти человека важны комплексные соединения Mn,Co,Cu,Zn. Амфотерные p – элементы Al,Pb,Sn также образуют комплексы. Образование комплексов: d-элементы – металлы комплексообразователи. Лигандами при этом выступают биологически активные вещества как правило, органического характера. или анионы неорганических кислот. Известны многочисленные ди-, три-, тетра-ядерные координационные соединения d-элементов. Белковые молеулы образуют с d-элементами бионеорганические комплексы – кластеры и биокластеры. Гидроксокомплексы – в качестве лигандов включают гидроксид- ионы: Na[Zn(OH)4] и др. Аминокомплексы – лиганд – молекулы аммиака: [Cu(NH3)4]SO4 и др. Оксалаты – соли щавелевой кислоты, трудно растворимы в воде. |
|
|
||
|
|
||
|
№ 6.4 Химия элементов р-блока. Электронные структуры атомов и ионов. Закономерности в проявлении устойчивых степеней окисления. Особенности реакций комплексообразования. Протолитические свойства соединений р-блока. Неорганические соединения углерода: цианиды, тиоцианаты, оксид углерода (II). Азот: азид-ион; оксонитрид азота (V), азотистая кислота и нитриты. Фосфор: полифосфаты. Кислород: свойства озона; синглетный кислород. Протолитические и редокс-амфотерные свойства пероксида водорода. Сера: тиосульфат натрия. Хлор: кислородсодержащие соединения хлора. Хлорид-гипохлорит кальция.
р-блок – 30 элементов IIIА – VIIIА-групп периодической системы. Большинство известных на Земле соединений – соединения именно этих элементов). У элементов IIIА – группы появляется первый электрон на p-орбитали. В других группах происходит последовательное заполнение p-подуровня до 6 электронов. В группах радиусы атомов и однотипных ионов увеличиваются. Энергия ионизации при переходе от 2p элементов к 6p-элементам уменьшается. т.к. по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам. С увеличением порядкового номера неметаллические свойства ослабевают. Вдоль периода у этих элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. Группах наблюдается склонность элементов образовывать комплексные соединения и повышаются координационные числа, однако уменьшается устойчивость максимальной положительной степени окисления и возрастает устойчивость низших степеней окисления. Углерод – мароэлемент №1. Из него состоят все ткани организма. Цианиды (цианистые соли) – соли синильной кислоты HCN. Цианиды калия и натрия применяют при добыче золота и серебра из руд (цианирование), в гальванотехнике. Чрезвычайно ядовиты. Тиоцианаты (роданиды) – соли и эфиры тиоциановой кислоты HSCN. Название по ярко-красной окраске тиоцианата железа Fe(SCN)3. Тиоцианаты аммония, калия и натрия применяют в аналитической химии как компоненты проявителей в фотографии. Тиоцианаты-эфиры – пестициды, стабилизаторы смазок и др. Оксид углерода (II) (угарный газ) – несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Термически устойчив, мало растворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с O, Cl, NaOH. С переходными металлами образует комплексные соединения без внешней сферы (карбонилы). Количественно реагирует с I2O5. Чрезвычайно ядовит. Блокирует перенос кислорода эритроцитами, вызывает сильное отравление и остановку дыхания. Азот – высокая электроотрицательность, типичный неметалл, основной компонент воздуха. Азотистая кислота – оксокислота. в свободном виде не получена, существует в водном растворе. Слабая кислота электролитическая диссоциация протекает только у несимметричной формы. Нейтрализуется щёлочами, гидратом аммиака. Проявляет окислительно-восстановительные свойства. Применяется только в виде солей. Фосфор – полифосфаты – соединения с полифосфорными кислотами (несколько остатков фосфорной кислоты соединены между собой) Кислород – самый распространённый в земной коре элемент (49,4%). Озон – аллотропная модификация кислорода. Озон отличается от кислорода более высокими температурами плавления и кипения, обладает резким запахом. Образование из кислорода сопровождается поглощением энергии ΔH0 = +285кДж. Озон поучают при действии электрического разряда в кислороде или под действием УФ. Озон – сильнейший окислитель Синглетный кислород - образуется как сопутствующий продукт, он образуется в организме при многих ферментативных реакциях, например реакции разложения перекиси водорода каталазой. Сера – схожа по свойствам с кислородом, но проявляет в соединениях степени окисления -2, +2, +4, +6. Тиосульфат натрия: получают при нагревании раствора Na2SO3 с порошком серы. Его применяют для лечения чесотки. После втирания его в кожу затем её обрабатывают 6% раствором HCl с итоге тиосульфат распадается на серу и диоксид серы Хлор – высокая электроотрицательность, неметалл. Входит в состав многих веществ – оксидов, кислот, солей, бинарных соединений. Гипохлорит кальция – соль хлорноватистой кислоты – HClO. Белый, при нагревании разлагается без плавления. Хорошо растворим в воде. Редакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. Хлорид кальция – белый, негидроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение. |
№ 7.1 Протолитические равновесия и процессы. Конкуренция за протон: изолированное и совмещенное протолитические равновесия. Константа кислотности и основности. Амфолиты. Изоэлектрическая точка. Буферное действие - основной механизм протолитического гомеостаза организма. Механизм действия буферных систем, их количественные характеристики. Расчет рН протолитических систем. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая. Понятие о кислотно-основном состоянии организма. Роль реакции гидролиза в биохимических процессах. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.).
Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называют протолитическими. Понятия «кислота» и «основание» являются относительными, так как одни и те же объекты могут проявлять как кислотные, так и основные свойства в зависимости от партнера по равновесию. Конкуренция за обладание протоном делает кислотно-оснoвную реакцию обратимой и приводит ее к состоянию протолитического равновесия с определенным значением константы равновесия Kс при T = Const. Частицы, способные к взаимодействию как с кислотами, так и соснованиями, называются амфолитами.. Типичным примером амфолитов являются аминокислоты. Сила кислот определяется их способностью отдавать протон, а оснований — принимать его. Мерой этой способности служат соответственно константа кислотности Кa и константа основности Кb.
Изоэлектрическая точка - точка нулевого заряда, состояние поверхности тела (или частицы дисперсной фазы) в контакте с раствором электролита, характеризующееся равным числом положительных и отрицательных зарядов в адсорбционном слое. Буферная система — это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при определенных внешних воздействиях. Протолитические буферные системы поддерживают постоянство рН при добавлении небольших количеств кислот и оснований. Раствор, содержащий одну или несколько буферных систем, называется буферным раствором.
Буферные
растворы имеют две главные количественные
характеристики
— рН и буферную емкость β. При выборе
буферного раствора для проведения
анализа или эксперимента руководствуются
необходимой величиной рН среды и
способностью ее сохранять это значение
при внесении кислот или оснований.
Если раствор содержит только одну
буферную систему, то для расчета рН
и β следует использовать отношение
а
и
сумму с концентраций компонентов
буферной системы НВ/В (знаки зарядов
частиц НВ и В для разных типов
систем разные):
Тогда рН раствора, содержащего буферную систему, определяется уравнением
Буферное действие раствора измеряется буферной емкостью, т.е. тем количеством щелочи или кислоты, которое требуется прибавить к 1 л раствора, чтобы значение его рН изменилось на единицу. Буферная емкость измеряется количеством кислоты или щелочи (моль или ммоль эквивалентов), добавление которого к 1 л буферного раствора изменяет рН на единицу. Способность раствора поддерживать определенное значение рН называется буферным действием. Буферным действием обладают: 1. Система слабая кислота – ее соль с сильным основанием, а также сочетание кислой и средней солей слабых кислот или двух кислых солей. 2. Система слабое основание – его соль с сильной кислотой: 3. Ионы и молекулы амфолитов – аминокислотные и белковые системы. Буферные системы крови обеспечивают поддержание относительного постоянства активной реакции крови, т. е. осуществляют регуляцию кислотно-щелочного состояния. В крови имеется 4 буферных системы: 1)бикарбонатная— угольная кислота-двууглекислый натрий (Н2СО3 — НаНСО3), 2)фосфатная — одноосновный-двуосновный фосфорнокислый натрий (НаН2РО4— На2НРО4); 3) гемоглобиновая— восстановленный гемоглобин-калийная соль гемоглобина (ННв-КНвО2); 4) буферная система белков плазмы. В поддержании буферных свойств крови ведущая роль принадлежит гемоглобину и его солям (около 75%), в меньшей степени бикарбонатному, фосфатному буферам и белкам плазмы. Белки плазмы играют роль буферной системы, благодаря своим амфотерным свойствам. Гидролиз (греч. hydor вода + lysis разложение) – разложение веществ, проходящее с обязательным участием воды и протекающее по схеме: AB + H-OH → AH + BOH Без этого процесса не было бы возможным усвоение пищевых продуктов, так как высасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться Реакциями нейтрализации - реакции получения солей смешиванием кислоты и основания. Вот примеры реакций нейтрализации: NaOH + HCl = NaCl + H2O (для получения хлорида натрия); 2NaOH + H2SO4 = Na2SO4 + 2H2O (для получения сульфата натрия); Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O (для получения нитрата кальция); В фармации применяют для количественного анализа неорганических кислот — соляной, серной, борной и органических кислот — уксусной, бензойной, винной, лимонной, салициловой. В биофармацевтических исследованиях методом нейтрализации определяют рКа кислот и рКb оснований, так как по значению этих величин можно прогнозировать способность лекарственных препаратов проходить через биологические мембраны. |
№ 7.2 Гетерогенные равновесия и процессы. Конкуренция за катион или анион: изолированное и совмещенное гетерогенные равновесия в растворах электролитов. Константа растворимости. Условия образования и растворения осадков. Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальциевого буфера. Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.
Гетерогенными называются системы, которые состоят из гомогенных частей, на границе которых свойства характеризуются разрывами непрерывности. Гетерогенная система состоит из нескольких фаз . Под фазой понимается совокупность гомогенных ограниченных поверхностями раздела частей системы, термодинамические свойства которых одинаково зависят от параметров состояния. Конкуренцию за общий катион выигрывает тот анион, который с этим катионом образует менее растворимое соединение. Аналогично протекают конкурирующие процессы за общий анион. Пример конкуренции за общий катион. Если в растворе присутствуют в равных концентрациях сульфат- и карбонат-ионы, то при введении в него ионов кальция в осадок переходит в первую очередь карбонат кальция, так как K2(CaCO3) < K2(CaSO4). Пример конкуренции за общий анион. При введении фосфат-ионов в раствор, содержащий в равных концентрациях ионы стронция и кальция, в первую очередь образуется твердая фаза, состоящая из фосфата стронция, так как это соединение имеет меньшую константу растворимости. Ks - константа равновесия взаимодействия малорастворимого вещества ионного типа с водой, при котором часть ионов переходит в жидкую фазу. Константа растворимости – константа равновесия процесса, описанного выше. Ks=Mx*Ay, где Mx - металл с коэффициентом х, Ay - анион с коэф. y. Условием образования в системе осадка является неравенство Пс > Кs , т.е. осадок выпадает в том случае, если произведение концентраций ионов, образующих электролит, в степенях, равных стехиометрическим коэффициентам, будет больше константы растворимости. При Пс < Ks осадок в системе не образуется, если же подобное выражение описывает состояние надосадочной жидкости, то произойдет частичное растворение осадка. При Пс = Ks в системе имеется равновесие (раствор насыщенный). Если в равновесную систему, содержащую в растворе ионы М y+, Ау- и твердую фазу МxAy ввести электролит, имеющий в составе либо Му+, либо Ау-, то это в соответствии с принципом Ле Шателье приведет к образованию дополнительного количества осадка. Следовательно, присутствие одноименного иона понижает растворимость малорастворимого электролита. Например, если к насыщенному раствору BaSO4 добавить K2SO4, то раствор становится пересыщенным (со временем некоторое количество сульфата бария перейдет в состав твердой фазы). Кальциевые буферы. Большая часть ионов Са2+, входящих в клетку, практически немедленно связывается цитоплазматическими местами связывания кальция. Показано, что только менее 1% ионов кальция, которые проникают в цитозоль, остается в несвязанном состоянии (11). Цитозольные кальциевые буферы представлены главным образом Са2+-связывающими белками, такими как парвальбумин, кальмодулин, тропонин-С, кальретинин, кальциунеурин, белок S-100 (25). Кроме того, цитозольная буферная емкость может быть опосредована АТФ, которая способна связывать значительное количество Са2+(64). 20-50% цитозольных кальциевых буферов могут быть удалены из цитоплазмы при перфузировании клетки, что показывает их мобильность, в то время как оставшаяся часть Са2+-связывающей емкости относится к фиксированным буферам. Мобильные кальциевые буферы могут играть важную функциональную роль, способствуя диффузии ионов Са2+в цитоплазме и распространению Са2+сигнала по клетке. Внутриклеточное введение эндогенных Са2+буферов (кальбиндина D28kи парвальбумина) через микропипетку приводило к увеличению скорости нарастания [Ca2+]iна несколько порядков и существенно влияло на кинетику изменения [Ca2+]i, что подтверждает роль мобильных Са2+буферов с низким молекулярным весом в эффективном регулировании внутриклеточной концентрации кальция. Изоморфизм - свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в кристаллической решетке, образуя кристаллы переменного состава; т.е. изоморфизм – это изменение химического состава минерала при сохранении его кристаллической структуры. Изоморфны, например, кристаллы дигидрофосфатов и арсенатов щелочных металлов: KH2PO4 (KDP), NH4H2PO4 (ADP), RbH2PO4, CsH2PO4, KH2AsO4, PbH2AsO4 и др. Все они при комнатной температуре кристаллизуются в одном классе с сходной внешней формой и близкими параметрами решетки, все имеют сегнето- и параэлектрические фазы, Этот изоморфный ряд интересен тем, что здесь ни замена катиона (например, K+ на NH4+), ни замена аниона (например, PO4- на AsO4-) не меняет морфологию кристалла. Ураты - соли мочевой кислоты, накапливаются в крови при некоторых болезнях, например при подагре, нефритах, лейкемиях; могут откладываться в тканях. Оксалаты (от греч. oxalís — щавель), кислые и средние соли щавелевой кислоты, например HOOC—COOK, NaOOC—COONa. Карбонаты - соли и эфиры угольной кислоты Н2СО3. Различают нормальные (средние) соли с анионом CO32- (напр., К2СО3) и кислые (гидрокарбонаты) с анионом НСО3- (напр., КНСО3). |
|
|
||
|
|
||
|
№ 7.3 Лигандообменные равновесия и процессы. Конкуренция за лиганд или за комплексообразователь: изолированное и совмещенное лигандообменные равновесия. Константа нестойкости комплекса. Инертные и лабильные комплексы. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином. Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. Механизм цито-токсического действия соединении платины.
Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса. Нарушения металлолигандного гомеостаза вызывают нарушения процесса обмена веществ, ингибируют активность ферментов, разрушают важные метаболиты, такие как АТФ, клеточные мембраны, нарушают градиент концентрации ионов в клетках. Поэтому создаются искусственные системы защиты. Должное место в этом методе занимает хелатотерапия (комплексонотерапия). Хелатотерапия – это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s–элементов. С практическими целями часто пользуются величиной, обратной константе устойчивости - константой нестойкости Кн:
Чем меньше константа нестойкости, тем прочнее комплекс. Константы нестойкости позволяют прогнозировать направление процессов комплексообразования. Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях. 1. Детоксикант (Lg): должен эффективно связывать ионы токсиканты (Мт, Lт), вновь образующиеся соединения (МтLg),должны быть прочнее, чем те, которые существовали в организме. Ку(МтLg) > Ку (МбLт), Ку(МбLтLg) > Ку (МбLт), где Ку – константа устойчивости; 2. Детоксикант не должен разрушать жизненно необходимые комплексные соединения (МбLб); соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов (MбLq), должны быть менее прочными, чем существующие в организме. Гемоглобин - дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам. Цитохромы - сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ. Кобаламины - природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. Физико-химические принципы транспорта кислорода гемоглобином - Атом (Fe (II)) (один из компонентов гемоглобина) способен образовывать 6 координационных связей. Из них четыре используются для закрепления самого атома Fe(II) в геме, пятая связь - для связывания гема с белковой субъединицей, а с помощью шестой связи происходит связывание молекулы О2 или СО2. Реакция, лежащая в основе переноса кислорода гемоглобином. HHb+ + O2 <=> HbO2 + H+
Токсичность
солей тяжелых металлов. Хорошо
известно, что загрязнение окружающей
среды соединениями токсичных элементов
— тяжелых металлов: ртути, свинца,
кадмия, хрома, никеля — может
приводить к отравлениям. Ядовитость
или токсичность таких соединений
во многих случаях объясняется
взаимодействием катионов тяжелых
металлов Мт
с бионеорганическими комплексами.
Реакция, описывающая это взаимодействие,
может быть записана в виде
Здесь MбL — комплекс иона биогенного металла Мб (Fe, Zn, Сu, Со) с биоорганическим лигандом L (например, порфирином); Мт — ион тяжелого металла. |
№ 7.4 Редокс-равновесия и процессы. Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста - Петерса. Сравнительная сила окислителей и восстановителей. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов. Влияние лигандообменного окружения центрального атома на величину редокс - потенциала. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Общие представления о механизме действия редокс-буферных систем. Токсическое действие окислителей (нитраты; нитриты, оксиды азота). Обезвреживание кислорода, пероксида водорода и супероксид-иона. Применение редокс-реакций для детоксикации.
Окислителями называются вещества или частицы, принимающие электроны от других веществ или частиц — восстановителей. Окисленную и восстановленную форму одного и того же вещества называют редокс-системой (редокс-парой). Для протекания окислительно-восстановительной реакции (редокс-реакции) необходимо наличие как минимум двух веществ, относящихся к разным редокс-системам. В общем виде реакции такого типа можно представить уравнением:
Потенциал,
возникающий на границе раздела металл
— раствор соли этого металла, называют
электродным.
Его величина φ определяется
уравнением Нернста:
Количественной
характеристикой редокс-систем, в
которых и окислитель, и восстановитель
находятся в растворенном состоянии,
является редокс-потенциал.
Для его вычисления используется
следующая форма уравнения
Нернста: Чем больше величина редокс-потенциала, тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей. Токсическое действие оксидов азота связано с их высокой окислительно-восстановительной способностью. Токсическое действие нитратов связано с восстановлением их до нитритов, аммиака, гидроксиламина под влиянием микрофлоры пищеварительного тракта и тканевых ферментов. Если в организм человека поступают высокие дозы нитратов, через 4–6 ч появляются тошнота, одышка, посинение кожных покровов, диарея. В зависимости от дозы нитратов, поступающих в организм, отмечают патоморфологические изменения разной степени: некроз или зернистая дистрофия в сильной степени в печени, почках, миокарде. Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов. В митохондриях окисление происходит в результате переноса электронов от органических субстратов- интермедиатов на элементный кислород, который при этом восстанавливается до воды: 1/2O2 + 2H+ +2e- = H2O В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие, разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются три молекулы АТФ. Значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ. |
№ 7.5 Совмещенные равновесия и конкурирующие процессы разных типов. Константа совмещенного равновесия. Совмещенные равновесия и конкурирующие процессы разных типов, протекающие в организме в норме, при патологии и при корреции патологических состояний.
Одним
из видов совмещения разнотипных
равновесий является протолитическое
— гетерогенное — равновесие. В
лабораторной практике с ним встречаются,
изучая растворимость осадков при
разных значениях рН. Растворимость
труднорастворимых солей, образованных
анионами слабых кислот, значительно
зависит от рН раствора, т.е. от
кислотности. Объясняется это
возникающими конкурирующими
процессами за анион слабой кислоты
между ионом металла и протоном:
В этом совмещенном равновесии объектом конкуренции является анион слабой кислоты (В"), а конкурирующими частицами - ион металла (М+) и протон (Н+). Выигрывает конкуренцию ион металла — образуется осадок, выигрывает протон — осадок растворяется. Преобладание того или иного процесса определяется общей константой совмещенного равновесия, которая определяется через частные константы равновесия, чаще всего диссоциативного типа (константы кислотности для протолитических равновесий, константы растворимости для гетерогенных, константы нестойкости для лиган-дообменных). Общая константа равновесия равна отношению произведения частных констант диссоциативного типа веществ, стоящих в левой части уравнения, к произведению частных констант диссоциативного типа веществ, стоящих в правой части уравнения. При наличии стехиометрических коэффициентов, отличных от 1, их необходимо учитывать, возводя частные константы равновесия в соответствующие степени. |
|
|
||
|
|
||
|
№ 8.1 Адсорбционные равновесия и процессы на подвижной границе раздела фаз. Поверхностная энергия Гиббса и поверхностное натяжение. Адсорбция. Уравнение Гиббса. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран.
Адсорбция - поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт А. — количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля. Адсорбция и абсорбция — поглощение в объёме тела, объединяются общим термином сорбция. Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. Например, молекулы, лежащие на поверхности раздела фаз жидкость — пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением. По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается. Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными (дифильные и ассиметричные, одноатомные спирты, одноосновные карбоновые кислоты, амины, эфиры). Изотерма адсорбции - зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре. П Уравнение Гиббса: Г=-Сср/RT Х ср.ро/ср.С При малых концентрациях пав углеводородные радикалы лежат на поверхности полярной жидкости, а полярные группировки погружены в нее. С увеличением конц. Пав в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит в пределе к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя, а котором молекулы пав предельно ориентированы.-это слой Ленгмюра. Биологическая мембрана (Даниэли и Давсон): основной элемент мембранных структур клетки явл. Биомолекулярный слой из молекул липидов, полярные(взаимодействуют с белками) группировки направлены наружу, а неполярные углеводородные радикалы – внутрь. Белки образуют симметричные и ассиметричные распределия белков в клеточных мембранах. Среди мембранных есть способные взаимодействовать с гидрофобными радикалами и проникать вглубь мембраны(интегральные белки) наиболее принятая – мозаичная модель.поры- ионные каналы(облад. Избирательной проницаемостью) Правило Дюкло-Траубе: с ростом длины углеводородного радикала адсорбция уменьшается. Т.е. с ростом длины углеводородной цепочки растет растворимость пав в неполярных растворителях. |
№ 8.2 Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов.
Вещество, на поверхности которого происходит Адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией. Адсорбированные молекулы рано или поздно покидают поверхность молекулы — десорбируются. Время, в течение которого молекула находится на поверхности, называется временем Адсорбции Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры. Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.). Уравнение Ленгмюра описывает количественно адсорбцию на подвижной и неподвижной ганицах раздела сред. a= amax x c/A+c amax-величина предельной адсорбции(при занятии всех активных центров адсорбента) моль/г Адсорбированные молекулы не только совершают движение вдоль поверхности адсорбента, но и колеблются, то приближаясь к поверхности, то удаляясь от неё. Чем выше температура, тем интенсивнее колебательное движение, а стало быть, больше вероятность того, что в процессе таких колебаний связь молекулы с поверхностью будет разорвана и молекула десорбируется. Благодаря этому с ростом температуры уменьшается время А. и равновесное количество адсорбированных молекул. Избирательная адсорбция (правило Фаянса) на поверхности данного адсорбента преимущественно адсорбируются те ионы, которые могут достраивать кристаллическую решетку этого адсорбента. KI + AgNO3 = AgI(т) + KNO3 Правило выравнивания полярностей (Ребиндер): на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей. Зависимость величины адсорбции от: 1. присутствие третьего компонента- растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента 2. взаимодействие между молекулами адсорбата и растворителя 3. электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом. Многие адсорбенты (активный уголь, каолин, иониты и др.) служат противоядиями, поглощая и удаляя из организма попавшие в желудочно-кишечный тракт вредные вещества. А. применяется для разделения газовых и жидких смесей, для осушки и очистки газов и жидкостей (например, очистки воздуха в противогазах). Одним из древнейших применений А. является очистка вина. В науке и технике приобрёл большое значение хроматографический метод анализа, основанный на различной способности компонентов анализируемой смеси к А. А. используют также для получения и очистки биологически активных веществ — витаминов, ферментов, гормонов, антибиотиков и др. |
№ 9.1 Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния.
Дисперсные системы - образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Д. с. по дна из фаз — дисперсная фаза — распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной фазе — дисперсионной среде. Д. с. по основной характеристике — размерам частиц или дисперсности (определяемой отношением общей площади межфазной поверхности к объёму дисперсной фазы) — делятся на грубо (низко) дисперсные и тонко (высоко) дисперсные, или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10-4 см и выше, в коллоидных — от 10-4—10-5 до 10-7 см. По агрегатному состоянию дисперсионной среды различают газодисперсные системы — аэрозоли (туманы, дымы), пыль; жидкодисперсные — золи, суспензии, эмульсии, пены; твёрдодисперсные — стеклообразные или кристаллические тела с включениями мельчайших твёрдых частиц, капель жидкости или пузырьков газа. Пыль, суспензии, лиофобные эмульсии — грубодисперсные системы; Золи — типичные высокодисперсные коллоидные системы, частицы дисперсной фазы которых (мицеллы) участвуют в броуновском движении и потому седиментационно устойчивы. Жидкие и твёрдые пены, состоящие из газовых ячеек-пузырьков, разделённых тонкими прослойками непрерывной фазы, представляют особую группу структурированных ячеистых систем. По интенсивности молекулярного взаимодействия фаз различают лиофильные и лиофобные Д. с. В лиофильных системах молекулярное взаимодействие между фазами достаточно велико и удельная свободная поверхностная энергия (поверхностное натяжение) на межфазной границе очень мала. Лиофильные системы образуются самопроизвольно (спонтанно) и имеют предельно высокую дисперсность. В лиофобных системах взаимодействие между молекулами различных фаз значительно слабее, чем в случае лиофильных систем; межфазное поверхностное натяжение велико, вследствие чего система проявляет тенденцию к самопроизвольному укрупнению частиц дисперсной фазы. Обязательное условие существования лиофобных Д. с. — наличие стабилизаторов, веществ, которые адсорбируются на поверхности раздела фаз и образуют защитные слои, препятствующие сближению частиц дисперсной фазы. Коллоидная химия, традиционное название физической химии дисперсных систем и поверхностных явлений. Термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. К. х. изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел. К ним относятся, например, самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем; застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур; взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения; явления в тонких жидких и твёрдых плёнках; самопроизвольное диспергирование жидкостей и твёрдых тел. |
|
|
||
|
|

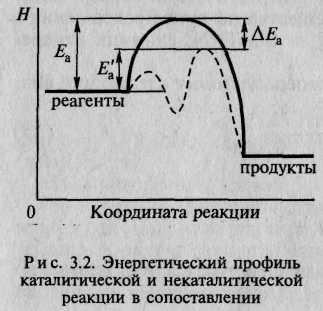 - константа
Михаэлиса.
Эта константа равна концентрации
субстрата, при которой скорость
реакции равна половине максимальной
скорости. Типичные значения KM
- от 10-6
до 10-1
моль/л. Константу скорости k2
иногда называют числом
оборотов фермента.
Она может изменяться в пределах от
10 до 108
мин-1
- константа
Михаэлиса.
Эта константа равна концентрации
субстрата, при которой скорость
реакции равна половине максимальной
скорости. Типичные значения KM
- от 10-6
до 10-1
моль/л. Константу скорости k2
иногда называют числом
оборотов фермента.
Она может изменяться в пределах от
10 до 108
мин-1 оверхностно-неактивные
вещ-ва
(адсорбирующие отрицательно) либо не
изменяют коэффициент поверхностного
натяжения водной фазы, либо незначительно
его увеличивают.(большинство
неорганический вещ-в: кислоты, щелочи,
соли) Мера адсорбции-Г(гамма)ед.
изм.-моль\м2.
оверхностно-неактивные
вещ-ва
(адсорбирующие отрицательно) либо не
изменяют коэффициент поверхностного
натяжения водной фазы, либо незначительно
его увеличивают.(большинство
неорганический вещ-в: кислоты, щелочи,
соли) Мера адсорбции-Г(гамма)ед.
изм.-моль\м2.