Электив в весеннем семестре по теме Элементы VII A группы
.docЭлектив по Общей химии в весеннем семестре по теме:
«Элементы VII A группы».
.
Галогены - по-гречески солероды.
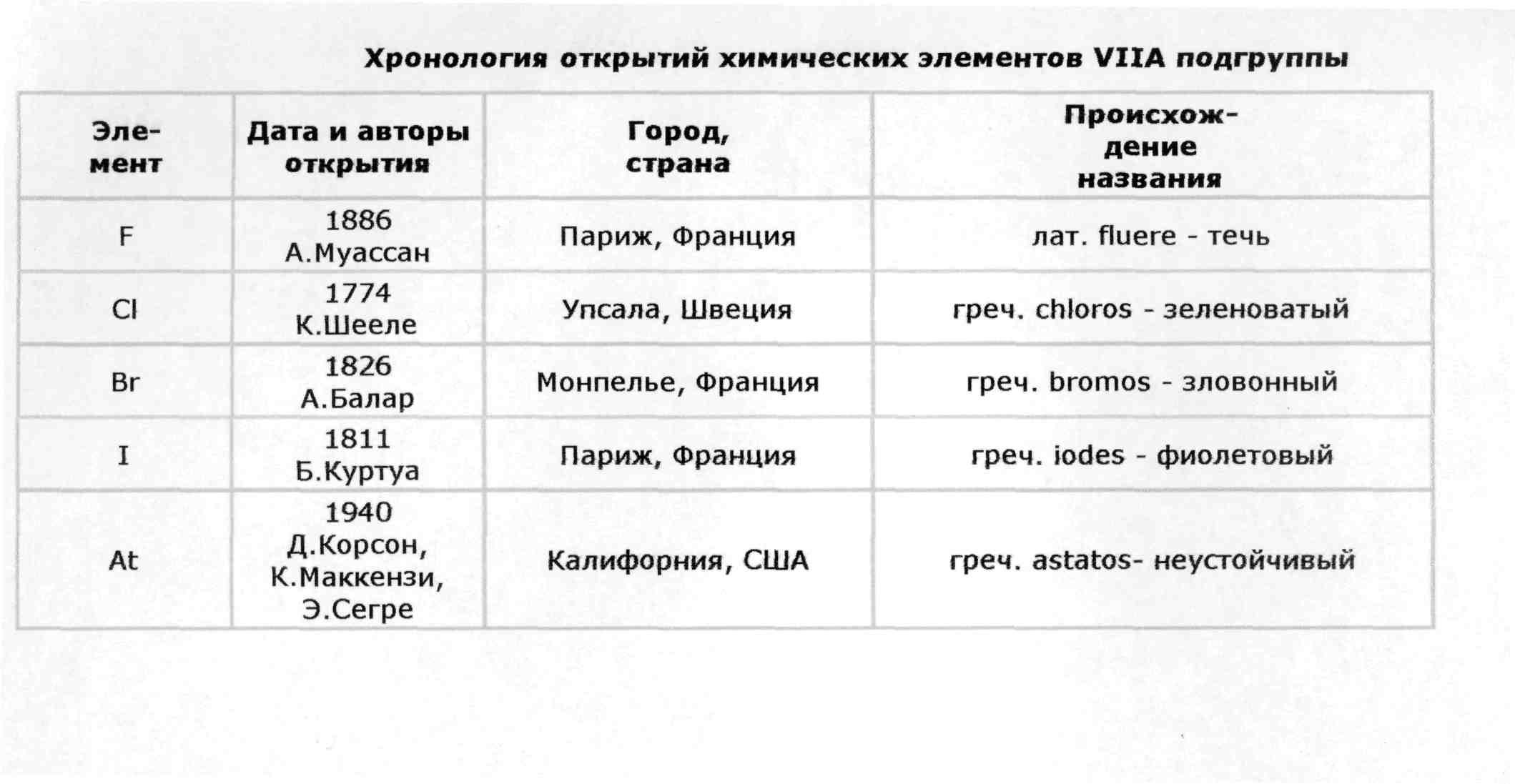
Электронная конфигурация ns2np5
В природе встречаются в виде солей. Фтор - CaF2 - флюорит, 3Сa3(PO4)2× CaF2 - фтороапатит, NaCl - самородная и в воде соляных озер, остальные NaГ и КГ - морская вода, водоросли.
В живом организме NaCl - плазма крови, HCl - желудочный сок, I - гормоны щитовидной железы, F - зубы.
Прежде всего, чтобы разобраться в свойствах элементов, заглянем в справочник. Последний элемент группы галогенов At - астат рассматривать не будем, поскольку он радиоактивный.
|
|
r (A) |
t(кип), оС |
DHдисс(Г2) кДж/моль |
I1, эВ |
Ea, эВ |
Э.О.
|
Eo, В (Г2/Г-) |
Степени окисления |
|
F |
0.72 |
-187 |
159 |
17.4 |
3.45 |
4.0 |
+2.87 |
-1 |
|
Cl |
0.99 |
-35 |
242.6 |
13.0 |
3.61 |
2.85 |
+1.36 |
-1,+1,+3,+5,+7 |
|
Br |
1.14 |
+59 |
223.6 |
11.84 |
3.37 |
2.75 |
+1.06 |
-“- |
|
I |
1.33 |
+183 |
213.5 |
10.45 |
3.0 |
2.20 |
+0.54 |
-“- |
|
|
I (Eи) |
Ee |
|
F |
|
|
|
Cl |
||
|
Br |
||
|
I |
Делаем выводы из вышеприведенной таблицы.
1) Радиус атомов растет сверху вниз, молекулы из двух атомов (вспомним метод МО и получим одиночную связь в молекуле). Молекулы неполярные, следовательно будут хорошо растворяться в неполярных растворителях - CCl4, бензол и прочая органика. Плохо растворяются в воде.
2) Фтор и хлор - газы, бром - жидкость, иод - твердое вещество, молекулярный кристалл. Молекулы иода удерживаются в решетке за счет сил Ван-дер-Ваальса. Эти силы слабые и они тем больше, чем больше радиус. Отсюда возгонка иода при небольшом нагревании.
3) Прочность двухатомных молекул падает по группе - уменьшается доля электронной плотности в пространстве между атомами. Исключение - фтор. Он кайносимметрик (первый раз заполняется p-оболочка, под ней нет такой же). Его молекула менее прочная, чем все остальные, поскольку сильное отталкивание электронов - они находятся близко друг от друга.
4) I1 убывает сверху вниз - увеличивается радиус, увеличивается экранирование внешних электронов. У иода потенциал ионизации близок к некоторым металлам. Отсюда соли иода IPO4, I(NO3)2. В целом все элементы - неметаллы, но неметаллический характер убывает сверху вниз. Астат - типичный металл.
5) Фтор - самый электроотрицательный элемент, вниз по группе электроотрицательность убывает. Это понятно, но вот почему Э.О. не симбатна Еа? У хлора Еа больше, чем у фтора. Причина в сути этих величин. Маленький фтор очень сильно тянет на себя электрон, но посадить его на свою орбиталь ему не очень выгодно из-за отталкивания (тесно). Опять сталкиваемся с кайносимметрией фтора.
6) Из предпоследней колонки узнаем, что все эти элементы - сильные окислители. Фтор взаимодействует со всеми элементами, даже с инертными газами (с Xe, Kr, Rn). В хлоре горят металлы и даже неметаллы (P). Бром активно окисляет органические соединения - страшный ожог при попадании на кожу. Иод используется как антисептик тоже ввиду его окислительной активности. Отсюда вывод, что в свободном виде эти элементы в природе встречаться не могут. Их надо получать из солей - окислять.
7) Получение. Фтор ничем окислить химически нельзя - он самый сильный окислитель. Поэтому его получают электролизом CaF2. Хлор в промышленности также получают путем электролиза поваренной соли, благо ее много. Но в лаборатории хлор уже можно получить окислением соляной кислоты или ее солей:
KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
Аналогично можно получать бром и иод. Но их можно получать и окисляя соли предыдущим галогеном:
KBr + Cl2 ® KCl + Br2
KI + Br2 ® KBr + I2
8) Взаимодействие с водой
Фтор разлагает воду при любом рН. F2 + H2O ® HF + O2
Хлор слабо разлагает воду при рН=0, с повышением рН лучше. Остальные воду не разлагают. Однако у всех галогенов кроме фтора (опять кайносимметрия) есть положительные степени окисления, следовательно, они в принципе могут диспропорционировать. Посмотрим, как это происходит.
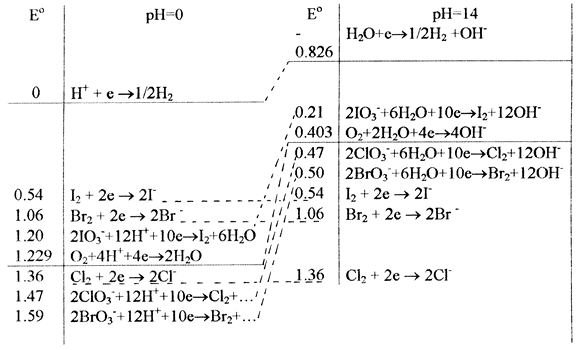
Очевидно, что при рН=14 все галогены, кроме F диспропорционируют, однако встает вопрос, при каком рН они начинают это делать. Очевидно, нужно, пользуясь уравнением Нернста определить, при каком рН пересекаются Е(Г2/Г-) и Е(ГО3-/Г2)
Ео(Г2/Г-) = Е(ГО3-/Г2) = Ео - (0.059×12/10) × рН
Какой рН для каждого элемента, посчитать самим. Но что интересно, часто для хлора в воде пишут диспропорционирование на HCl и HClO. Попробуйте сами объяснить, почему это диспропорционирование идет в воде только приблизительно на 20%
Водородные соединения галогенов
Общий подход к рассмотрению классов соединений:
1) Строение
2) Устойчивость, получение
3) Взаимодействие с водой
4) Кислотно-основные свойства
5) Окислительно-восстановительные свойства
|
НГ |
HF |
HCl |
HBr |
HI |
|
DHof |
-270 |
-92 |
-36 |
+26 |
|
Возрастание кислотных свойств® |
||||
|
Возрастание восстанови- тельных свойств® |
||||
Строение НГ
![]() получаем
три орбитали и еще две орбитали оказываются
несвязывающими (py и pz).
получаем
три орбитали и еще две орбитали оказываются
несвязывающими (py и pz).
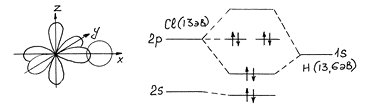
С точки зрения МО самой прочной должна быть молекула HCl - орбитали наиболее близки по энергии. Однако самая прочная на самом деле HF - за счет водородных связей. У HF даже есть кислые соли - KHF2.
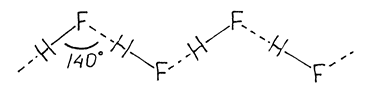
Получение - а) прямой синтез из элементов -возможен только для HF и HCl (cм. DHof). б) Замещение металлов в солях : KГ + H2SO4 ® K2SO4 + НГ.
При этом кислота должна быть сильной (чтобы вытеснить сильную НГ), нелетучей и концентрированной (иначе реакция будет обратимой, кислота НГ не будет улетучиваться) и не окислять галогены. К сожалению концентрированная H2SO4 является окислителем и окисляет Вr - до Br2 , I- до I2, при этом сама восстанавливается до SO2 и H2S соответственно.
в) Гидролиз: PI3 +H2O ® H3PO3 + HI
Кислоты - сила кислот возрастает вниз по группе. HF - слабая кислота
HF не проявляет восстановительных свойств. Остальные - восстановители.
Другие бинарные соединения
Соединения с металлами - соли галогеноводородных кислот.
а) Получение. Прямой синтез из элементов (получаем высшие степени окисления, т.к. галогены - сильные окислители). Растворение металлов в кислотах - низшие степени окисления (окислитель - ион Н+).
б) Связь преимущественно ионная, кристаллические вещества. Большинство хорошо растворимо в воде, кроме солей тяжелых металлов - AgCl, CuCl, AuCl и т.д.
Переход слева направо в Периодической системе плавно приводит нас к соединениям неметаллов с галогенами - галогенангидриды.
SiCl4 + H2O ® H2SiO3 + HCl.
Реагируют с солями как кислотные и основные оксиды
KCl + TiCl4 ® K2TiCl6
Интергалоидные соединения.
Галогены реагируют друг с другом, при этом менее электроотрицательный элемент приобретает положительную степень окисления, более электроотрицательный - отрицательную. Естественно, все эти соединения - галогенангидриды.
Иод растворяется в растворе KI.
I- + I2 ® I3-
ClF, ClF3
BrF, BrF3, BrF5, BrCl
ICl, ICl3, ICl5, ICl7; IF7.
Также подвергаются полному гидролизу и присоединяют соли галогенов в качестве кислот Льюиса
ICl5 + H2O ® HIO3 + HCl
ICl3 + KCl ® KICl4
К вопросу о степенях окисления. Правило четности для непереходных элементов - если у элемента нечетное число валентных электронов, он проявляет нечетные значения степеней окисления, если же число валентных электронов четное - четные степени окисления.
Причина тому тот факт, что, например, хлор может отдать один электрон (неспаренный). Для реализации более высокой степени окисления нужно один электрон возбудить на более высоколежащий уровень (d-орбиталь). Но тогда мы получим сразу два неспаренных электрона дополнительно, и степень окисления увеличивается на 2.
Кислородные соединения галогенов
Оба элемента - О и Г - электроотрицательные, прочных соединений не должно быть.
2F2 + 2NaOH = OF2 + 2NaF + H2O. Оксид фтора.
Термодинамические данные для известных оксидов галогенов
|
|
Cl2O |
ClO2 |
Cl2O7 |
ClO2 |
I2O5 (кр) |
|
DHfo, кДж/моль |
+79 |
+105 |
+251 |
? |
-183.3 |
Для брома термодинамических данных нет. Все оксиды, кроме I2O5, нестабильны, их образование из элементов сопровождается колоссальным уменьшением энтропии. Сл-но, их можно получать только косвенным путем. Высшие оксиды - путем дегидратации соответствующих кислородных кислот. Низшие:
2HgO + 2Cl2 ® Cl-Hg-O-Hg-Cl + Cl2O - ангидрид HClO
KClO3 + H2SO4 ® HClO3 + KHSO4
3HClO3 ® 2ClO2 + HClO4 + H2O бурый газ, диспроп. в воде
2ClO2 + 2O3 ® Cl2O6(ж)
Значение имеют только оксосоединения галогенов в растворе
|
Кислота |
HClO |
HClO2 |
HClO3 |
HClO4 |
|
Название |
хлорноватистая |
хлористая |
хлорноватая |
хлорная |
|
Соли |
гипохлориты |
хлориты |
хлораты |
перхлораты |
|
|
увеличивается сила кислот® |
|||
|
|
¬увеличивается окислительная активность |
|||
Для брома - HBrO, HBrO3, HBrO4 - последняя очень неустойчива, получается: NaBrO3 + XeF2 + H2O ® NaBrO4 + 2HF + Xe
Для иода - HIO - амфотерная, HIO«H+ + IO-; HIO«I+ + OH-;
HIO3, H5IO6 - иод большой, предпочитает иметь вокруг себя октаэдрическое окружение, sp3d2-гибридизация, двухосновная кислота.
Рассмотрим на примере хлора в кислой среде.
ClO4- воду не окисляет, следовательно стабилен (окисляться ему некуда, диспропорционировать тоже). ClO3- - Eo(ClO3-/HClO) = 1.43(вычислили сами)
Следовательно, он окисляет воду и диспропорционирует. HСlO2 активно окисляет воду и диспропорционирует. HClO - самый сильный окислитель, окисляет воду и диспропорционирует на Cl2 и HClO3. Cl2 слабо окисляет воду и не диспропорционирует. Иными словами, в кислой среде стабильны лишь ClO4- и Cl-. В щелочной среде ClO- несколько более стабилен (отбеливатели всегда щелочные).
Сами убедитесь, что при рН=0 устойчивы только Br2 и Br -, HIO3, I2 и I-; в щелочной стабилизируются BrO3-, IO3-, IO-, но диспропорционируют Br2 и I2.
Астат. Этот химический элемент семейства галогенов имеет символ At и атомный номер 85, он существует только в следовых количествах в некоторых минералах. Еще в 1869 Д.И.Менделеев предсказал его существование и возможность открытия в будущем. Астат был открыт Д.Корсоном, К.Маккензи и Э.Сегре в 1940. Известно более 20 изотопов, из которых наиболее долгоживущие 210At и 211At. По некоторым данным, при бомбардировке 20983Bi ядрами гелия образуется изотоп астат-211; сообщалось, что астат растворим в ковалентных растворителях, может образовывать At–, как и другие галогены, и, вероятно, возможно получение иона AtO4–. (Эти данные удалось получить на растворах с концентрацией 10–10 моль/л.)
Применение в медицине.
Хлорид аммония – нашатырь.
NH4Cl = NH4+ + Cl-
NH4+ + 2H2O
![]() NH3 . H2O + H3O+,
NH3 . H2O + H3O+,
Йод
Военные врачи России еще в 1855 году, намного раньше, чем настойку иода, начали использовать для лечения ран, язв и флегмон синий порошок – сухой иодокрахмал (1 г иода на 100 г крахмала). Действие этого средства оказалось очень эффективным: очищение и рубцевание ран наступало после третьей перевязки. Иодокрахмалом лечили и острую дизентерию.
Позже иодокрахмал стали добавлять в поваренную соль для профилактики эндемического зоба (сейчас продается «иодированная поваренная соль», которая содержит не иодокрахмал, а небольшую добавку иодата калия KIO3).
Для приготовления иодокрахмала сухой крахмал взбалтывают в кипяченой воде и при непрерывном перемешивании добавляют к взвеси немного иодной настойки. При этом частички крахмала синеют. Биологическая активность и бактерицидные свойства иодокрахмала обусловлены присутствием в его структуре комплексных анионов [I3]- и [I5]-.
В 1927 году немецкий химик Герман Штаудингер (1881–1965), один из создателей химии полимеров и впоследствии нобелевский лауреат, обнаружил, что иод взаимодействует с поливиниловым спиртом (как с крахмалом), образуя соединение синего цвета с антимикробными свойствами – иодинол. Иодинол устойчив только в кислой среде, а в щелочной обесцвечивается и теряет бактерицидные свойства. Иодинол оказался незаменимым средством для лечения хронического тонзиллита, острых ангин, периодонтита (воспаления корневой оболочки зуба), отита и даже желудочно-кишечных инфекций. Лекарственным действующим началом в иодиноле служат анионы [I3]- и [I5]-, находящиеся в виде цепей в полимерной структуре поливинилового спирта [–CH2–CH(OH)–]n. Эти частицы, постепенно выделяясь из полимера, убивают болезнетворные микроорганизмы.