
- •Визначення густини олії 33
- •Визначення показника заломлення олії 34
- •Список умовних позначень і скорочень
- •Розділ I літературний огляд
- •Загальна характеристика гранату (Punica granatum)
- •Біологічно активні речовини
- •Водорозчинні вітаміни До цієї групи відноситься значна кількість вітамінів, в тому числі вітаміни комплексу в, вітамін с та ін.
- •Алкалоїди
- •Флавоноїди
- •Розділ II. Обґрунтування напрямку дослідження
- •Роль біологічно активно речовин в процесі життєдіяльності людини
- •Розділ III. Методи дослідження
- •Виділення олії методом екстрагування органічним розчинником
- •Визначення хімічних показників олії
- •Визначення кислотного числа
- •Визначення числа омилення
- •Визначення ефірного числа
- •Визначення йодного числа
- •Визначення пероксидного числа
- •Визначення показника заломлення олії
- •Визначення густини олії
- •Дослідження жирнокислотного складу рослинних олій методом газової хроматографії.
- •Якісне визначення вітамінів
- •Вітамін а (Ретинол)
- •Вітамін d (Кальциферол)
- •Вітамін е (Токофенол)
- •Вітамін в2 (Рибофлавін)
- •Вітамін в6 (Піродиксин)
- •Вітамін р (Рутин)
- •Вітамін с (Аскорбінова кислота)
- •Вітамін рр (Вітамін в5, Нікотинамід)
- •4.3.1. Визначення густини олії
- •4.3.2. Визначення показника заломлення олії
- •Розділ V. Обговорення результатів дослідження
- •Визначення фізико-хімічних характеристик олії граната
- •Визначення жирнокислотного складу олій методом газорідинної хроматографії
- •Визначення вітамінного складу шкірки і соку граната.
- •Висновки
- •Список використаної літератури
Визначення хімічних показників олії
Визначення кислотного числа
Кислотне число – це кількість мг гідроксиду калію, необхідна для нейтралізації вільних жирних кислот в 1 г жиру. Кислотне число характеризує якість жиру. Так, у жирі, виготовленому з дозрілого насіння, вільних жирних кислот мало, а у жирі з недозрілого насіння – багато. При зберіганні жиру спостерігається накопичення вільних жирних кислот, тобто зростає кислотність. Підвищення кислотності вказує на зниження якості жиру.
Принцип методу полягає в тому, що вільні жирні кислоти, які містяться в жирі, відтитровують 0,1 н. розчином гідроксиду калію. Титрування доцільно проводити гідроксидом калію, а не гідроксидом натрію, оскільки утворені калієві мила краще розчиняються в умовах досліду.
Хід роботи. До 1г жиру додають 5мг спирту нейтралізованого фенолфталеїном, добре перемішеють до максимального розчинення вільних жирни кислот і титрують розчином KOH до появи рожевого забарвлення( забарвлення не повинно зникати протягом 0,5 – 1 хв.).
Кількість KOH, мг, витрачену на титрування вільних жирних кислот, що містяться в 1г жиру, визначають за формолою:
КЧ=AQ/a
де А – об’єм розчину KOH (0,1 моль/л), витрачений на титрування досліджуваної проби, мл;
а – наважка жиру, г;
Q – кількість KOH (5,61 мг), еквівалентна 1мг розчину KOH (0,1 моль/л).
Визначення числа омилення
Число омилення — кількість міліграмів їдкого калі КОН, необхідна для нейтралізації вільних і зв'язаних з гліцерином жирних кислот, одержаних при омиленні 1 г жиру.
Хід роботи. В одну колбу (досліджувану пробу) поміщають 0,5г жиру, в другу (контрольну пробу) – 0,5мл води. В обидві колби доливають по 15мл спиртового розчину KOH і кип’ятять із зворотнім холодильником на водяній бані протягом 50 хв до повного омилення гліцеридів і нейтралізації вільних жирних кислот. Потім у обидві колби додають по 10 краплин розчину фенолфталеїну та титрують прозчином HCl до зникнення рожевого забарвлення (до нейтральної реакції).
Кількість KOH у мг, витрачена на нейтралізацію всіх жирних кислот, що містяться 1г жиру, визначають за формолою:
ЧО=(В-А)fQ/a
де (В-А) – різниця результатів титрування контрольного та досліджуваного зразків розчином соляної кислоти (0,5 моль/л), мл;
а – наважка досліджуваного жиру, г;
Q – кількість KOH (28 мг), яка еквівалентна 1 мл розчину KOH (0,5 моль/л).
Визначення ефірного числа
Це число визначать за різнацею між ЧО жиру та його КЧ
ЕЧ=ЧО-КЧ
Визначення йодного числа
Йодне число – кількість грамів йоду, потрібного для насичення ненасичених жирних кислот, що містяться в 100 г жиру. Дає уявлення про ступінь ненасиченості жиру, про здатність до висихання, прогіркання та інших зміни, що відбуваються при зберіганні та переробці жирів. Чим більше у жирі ненасичених жирних кислот, тим вище йодне число. Зменшення йодного числа є показником псування жиру.
Принцип методу полягає в тому, що ненасичені жирні кислоти приєднують галогени за місцем подвійних зв’язків.
Ме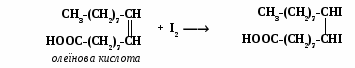 ханізм
реакції взаємодії ненасичених жирних
кислот з йодом:
Йод,
що не прореагував, відтитровують 0,1 н.
розчином тіосульфату натрію:
J2 +
2Na2S2O3
2NaJ + Na2S4O6
ханізм
реакції взаємодії ненасичених жирних
кислот з йодом:
Йод,
що не прореагував, відтитровують 0,1 н.
розчином тіосульфату натрію:
J2 +
2Na2S2O3
2NaJ + Na2S4O6
Хід роботи. В одну колбу (досліджувана проба) вносять наважку 0,1 – 0,2 г, у другу (контрольна проба) – 0,1 – 0,2 мл води, по 10 мл спиртового розчину йоду, перемішують і залишають на 15 хв. Далі вміст колб титрують розчином Na2S2O3 до появи жовтуватого забарвлення. Потім, додавши 1 мл розчину крохмалю, суміш титрують до зникнення синього забарвлення.
Йодне число визначають за формолою: ЙЧ=(В-А)fQ1000/a1000
де (В-А) – різниця резудбтатів титрування контрольного та досліджуваного зразків у розчині Na2S2O3 (0,05 моль/л), мл;
а – наважка розвину жиру, г;
f – коефіцієнт поправки на титр розчину Na2S2O3 (0,05 моль/л);
Q – кількість J2 (12,69 мг), еквівалент на 1 мг розчину Na2S2O3(0,05 моль/л).
