- •Высшего профессионального образования «Курский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
- •Часть 1
- •Рецензенты
- •Задание № 1
- •Формулы, используемые при решении задач по изучаемой теме:
- •Задание № 3
- •Задание № 4
- •Задание № 5
- •Задание № 7
- •Задание № 8
- •Задание № 10
- •Вариант № 1
- •Задание № 11
- •Задание № 12
- •Задание № 13
- •Задание № 14
- •Задание № 17
- •Обязательные для выполнения задания
- •Задание № 18
- •Причины респираторного ацидоза: заболевания органов дыхания, гиповентиляция легких, угнетение дыхательного центра некоторыми препаратами, например, барбитуратами.
- •Причины респираторного алкалоза: вдыхание разреженного воздуха, чрезмерное возбуждение дыхательного центра вследствие поражения мозга, гипервентиляция легких, развитие тепловой отдышки.
- •Обязательные для выполнения задания
- •Задание № 19
- •Задание № 20
- •Список использованной литературы
- •Приложение Справочные данные
- •Стандартные термодинамические потенциалы
- •Константы диссоциации слабых электролитов
- •Произведение растворимости труднорастворимых электролитов
- •Константы нестойкости комплексных ионов
- •Стандартные потенциалы полуреакций восстановления в растворе
Задание № 10
1. Реакции простые и сложные? Как Вы это понимаете?
Простыми реакциями называют реакции, протекающие в одну стадию, т.е. в ходе единичного столкновения частиц. Для таких реакций химическое уравнение полностью отражает, какие частицы и в каком соотношении непосредственно участвуют в элементарном акте реакции. Но большинство химических и все биохимические реакции являются сложными. Сложными реакциями называют реакции, протекающие в несколько стадий, каждая из которых является простой реакцией. Таким образом, все сложное состоит из простого.
2. Что называют скоростью простой химической реакции?
Скоростью химической реакции является количество элементарных актов реакции в единицу времени.
Поскольку подсчитать количество элементарных актов не представляется возможным, то скорость определяют следующим образом:
Скоростью химической реакции называют изменение количества вещества (как реагента, так и продукта) в единицу времени в единице объема (для гомогенных процессов), или на единицу поверхности (для гетерогенных).
Скорость реакции измеряется в моль/лс и не может быть отрицательной.
3. Что такое путь реакции?
Путем реакции называется изменение потенциальной энергии реагирующей системы в ходе химической реакции (энергетический профиль реакции), что отражается в механизме процесса. Механизм процесса показывает, через какие стадии и промежуточные соединения протекает данный процесс.
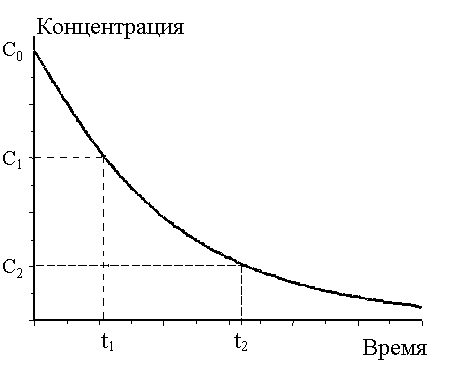
4. Что такое средняя скорость химической реакции?
Средней
скоростью химической реакции по данному
компоненту называют изменение концентрации
вещества за данный промежуток времени.
![]() .
Знак «+» ставится для измерения скорости
по изменению концентрации продукта
реакции, а знак «‑» - по реагенту.
.
Знак «+» ставится для измерения скорости
по изменению концентрации продукта
реакции, а знак «‑» - по реагенту.
|
Кинетическая кривая по реагенту для расчета средней скорости реакции. |
5. Чем отличается истинная скорость химической реакции от мгновенной?
Понятия истинной
и мгновенной скорости являются синонимами.
Мгновенная скорость характеризует
скорость в данный момент времени.
Определяется по формуле:
![]()
|
Определение мгновенной скорости химической реакции как тангенса угла наклона касательной к кинетической кривой в момент времени t. |
6. Закон действующих масс для скорости простой реакции.
Количественная зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, называемым законом действующих масс: скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
aA + bB = fF + dD
v = k[A]a[B]b, где a и b ‑ стехиометрические коэффициенты реагентов; [A] и [B] – молярные концентрации реагентов, k – константа скорости реакции.
7. Зависимость скорости простой реакции от концентрации реагирующих веществ.
Из закона действующих масс (см. предыдущий вопрос) скорость реакции возрастает с увеличением концентрации.
8. Понятия о молекулярности и порядке реакции.
Молекулярностью процесса называется количество частиц, участвующих в элементарном акте химической реакции. Вывод о молекулярности процесса можно сделать только на основании знания механизма данной реакции. Реакции могут быть моно-, би- и тримолекулярные.
Порядок реакции по реагенту равен показателю степени, в которую надо возвести концентрацию данного реагента в кинетическом уравнении реакции, чтобы вычисленная по этому уравнению скорость была равна скорости, найденной экспериментально. Выделяют порядок реакции по реагентам и суммарный порядок реакции, который равен сумме порядков по реагентам.
Несоответствие между порядком реакции по реагенту и его стехиометрическим коэффициентом в уравнении реакции свидетельствует о сложности и многостадийности данного процесса.
9. В каком случае порядок реакции и молекулярность совпадают?
Для простой реакции суммарный порядок и молекулярность совпадают.
10. Мономолекулярные реакции ‑ можно ли утверждать, что это псевдо-бимолекулярные процессы.
Все химические процессы протекают в ходе столкновений, в которых участвуют две или три реагирующие частицы (одной из которых может быть «стенка» реакционного сосуда). Таким образом, мономолекулярные реакции представляют собой псевдо-бимолекулярные процессы.
11. Почему не существует гексамолекулярных реакций?
Согласно теории вероятности одновременное столкновение даже трех частиц равно нулю. Поэтому осуществление гексамолекулярных реакций невозможно. Существование тримолекулярных реакций объясняется возможностью существования «времяпролетного комплекса», т.е. третья частица сталкивается с двумя за время их пролета мимо друг друга. Существует всего несколько достоверно определенных тримолекулярных реакций. Например: 2NO(г) + Cl2(г) = 2NOCl(г).
12. Какова скорость реакций нулевого порядка?
Скорость реакции нулевого порядка постоянна и равна константе скорости реакции.
13. Константа скорости реакции? Какова ее размерность?
Константа скорости реакции является индивидуальной характеристикой реакции. Значение константы скорости реакции зависит от природы реагирующих веществ, температуры системы и наличия в ней катализатора. Значение константы скорости для данных условий не зависит от концентрации реагентов и поэтому остается неизменным в течение реакции и является ее фундаментальным кинетическим параметром. Значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов, равных 1 моль/л.
Примечание: по техническим причинам вопросы №№ 14-15 расположены в конце «состава».
16. Влияние температуры на скорость простой химической реакции.
Скорость химической реакции возрастает с увеличением температуры, что отражено в правиле Вант-Гоффа. Attention!!! Не путайте Правило Вант-Гоффа, касающееся зависимости скорости реакции от температуры, с Законом Вант-Гоффа об осмотическом давлении растворов!
17. Правило Вант-Гоффа. Температурные коэффициенты: 10, 5.
Правило Вант-Гоффа: с увеличением температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза.
![]() ,
где
,
где
v2 – скорость реакции при температуре Т2 (конечной);
v1 – скорость реакции при температуре Т1 (начальной);
10 ‑ температурный коэффициент реакции при увеличении температуры на 10 градусов.
Для
обычных химических реакций величина
10
= 2-4, а для ферментативных реакций может
достигать значения 7-9. Поэтому используется
5,
показывающий во сколько раз увеличится
скорость реакции с увеличением температуры
на 5 градусов, поскольку даже такое
колебание температуры тела человека
сильно сказывается на его самочувствии.
Правило Вант-Гоффа для 5
может быть записано следующим образом:
![]()
18. Энергия активации простой реакции и природа веществ.
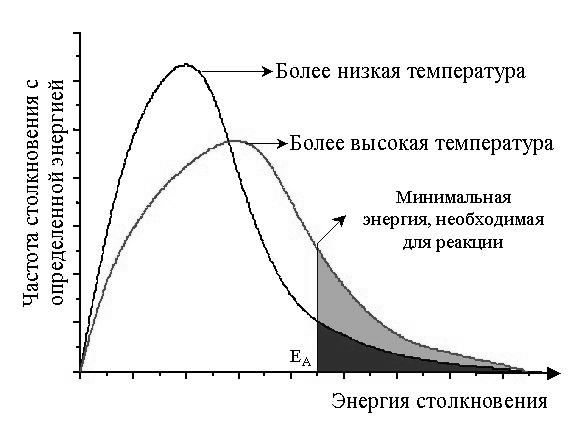
Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений. Основные постулаты этой теории следующие: не каждое столкновение приводит к акту химического взаимодействия, а только те, которые обладают энергией, необходимой для данного взаимодействия (энергией активации ЕА); при соударении частицы должны быть определенным образом сориентированы относительно друг друга.
|
Число активных соударений при различных температурах. Площадь заштрихованной области показывает число частиц, вступающих в химическую реакцию. |
Энергия активации – это минимальная энергия взаимодействующих частиц достаточная для того, чтобы эти частицы вступили в химическое взаимодействие. Энергия активации зависит от природы веществ и пути протекания реакции.
19. Промежуточные и активированные комплексы.
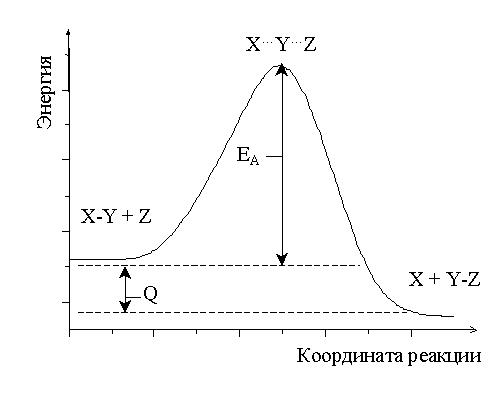
Энергия активации необходима для возникновения непрочного переходного комплекса, в котором происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив и может быстро распадаться, образуя либо исходные, либо конечные вещества.
|
[X…Y…Z] – промежуточный (активированный) комплекс; Q – тепловой эффект реакции. |
20. Зависимость скорости простой химической реакции от энергии активации.
С увеличением энергии активации скорость химического процесса уменьшается. Опытным путем установлено, что реакции с ЕА меньше 50 кДж/моль при стандартных условиях идут с высокой скоростью. Это характерно для реакций с участием радикалов или ионов. Если реакция имеет ЕА больше 100 кДж/моль, то ее скорость в этих условиях неизмеримо мала.
14. Уравнение Аррениуса.
![]() ,
где
,
где
k – константа скорости реакции при температуре Т;
А – предэкспоненциальный множитель (коэффициент Аррениуса), учитывающий частоту столкновений частиц, ориентированных определенным образом.
е – основание натурального логарифма (2,718);
ЕА – энергия активации реакции Дж/моль;
R – универсальная газовая постоянная (8,314 Дж/мольК);
Т – абсолютная температура, К.
15. Уравнение Аррениуса и его использование для расчета скорости биологических процессов.
Изучение температурной зависимости скорости превращения биосубстратов показывает, что ускоряющее действие ферментов связано с существенным уменьшением энергии активации. Используя уравнение Аррениуса и закон действующих масс можно вычислить увеличение скорости биохимических процессов в присутствии ферментов.