
- •12 Лекция 11. Спектроскопия комбинационного рассеяния Лекция 11. Cпектроскопия комбинационного рассеяния
- •Классическая спектроскопия комбинационного рассеяния
- •Спектры комбинационного рассеяния
- •Частота, интенсивность и поляризация
- •Рамановские спектрометры и микроскопы
- •Определение вторичной структуры макромолекул из спектров комбинационного рассеяния
- •Конформация днк
Рамановские спектрометры и микроскопы
Для того чтобы получить спектр комбинационного рассеяния белка или нуклеиновой кислоты, нужно поместить образец в фокус лазерного луча. Рассеянный свет собирается системой линз и направляется через монохроматор на детектор фотонов. Спектр представляет собой зависимость интенсивности рассеянного света от разности частот рассеянного и падающего излучения. Полоса определенной частоты в комбинационном спектре соответствует колебательной моде той же частоты. Еще раз подчеркнем, что получаемый спектр не зависит от частоты лазерного излучения.
Для исследования структуры белков и нуклеиновых кислот с помощью комбинационного рассеяния используют три типа приборов: 1) классический рамановский спектрометр, 2) рамановский микроскоп, и 3) ультрафиолетовый резонансный спектрометр.
В классическом рамановском спектрометре используется свет с длиной волны в видимой области. Поскольку обычные биологические образцы (белки или нуклеиновые кислоты в виде порошков, кристаллов, волокон или растворов) прозрачны в видимом свете, они мало или совсем не нагреваются лазерным лучом, что позволяет избежать деградации образца. Классические спектры комбинационного рассеяния белков или нуклеиновых кислот были получены для образцов объемом 5-50 мкл в стеклянном капилляре, укрепленном в медном держателе, помещенном в воду с контролируемой температурой, в котором имеются каналы для падающего и рассеянного света. Последний собирается под прямым углом по отношению к падающему пучку. Стандартная концентрация образца составляет 2-20 мг·мл-1, или около 20-100 мМ.
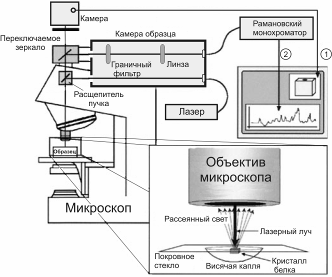
Рис. 59.4. Схема рамановского микроскопа. Спектры можно наблюдать на экране компьютера (вставка 1). На вставке 2 показано приспособление для наблюдения спектров комбинационного рассеяния от одиночного белкового кристалла в висячей капле
Рамановская микроскопия позволяет исследовать одиночные кристаллы белка в висячей капле in situ (рис. 59.4). Записываемый спектр кристалла относится к объему в точке фокуса лазерного луча, обычно имеющего диаметр ~20 мкм и глубину 50 мкм. Концентрация белка в таком объеме, занимаемом кристаллом, составляет примерно 50 мМ, что обеспечивает высокое качество получаемых данных. Комбинационное рассеяние окружающего маточного раствора дает пренебрежимо малый вклад, поскольку концентрация белка в нем менее 1 мМ. Все это позволяет использовать рамановскую микроскопию для изучения свойств белковых кристаллов в висячей капле.
В общем случае, рамановская спектроскопия и рамановская микроскопия пригодны для прямого сравнения свойств молекул как в растворе, так и в кристалле, что предопределяет ценность методик.
Определение вторичной структуры макромолекул из спектров комбинационного рассеяния
Различные конформации полипептидной цепи имеют свои отличительные черты в спектрах комбинационного рассеяния. В таблице 59.1 представлены некоторые комбинационные моды, используемые для получения информации о структуре и динамике белков. Из перечисленных в таблице мод одной из наиболее чувствительных к конформации является мода амид-I. Так, частоты колебаний полосы амид-I равны в H2O для α-спирали 1650 ± 5 см-1 и для β-слоя 1670 ±3 см-1. Данный факт, говорит о том, что карбонильная группа сильнее поляризована, то есть имеет больший дипольный момент в α-спирали, чем в β-слое. Замена атомов водорода на дейтерий приводит к уменьшению частоты из-за большей массы последнего. Считается, что частота 1632 ±5 см-1 соответствует в D2O α-спиральной конформации, а частота 1659 ± 3 см-1 − β-слою.
Таблица 59.1 Основные (маркерные) полосы белков в комбинационном рассеянии (Peticolas, 1995).
Полосы и их частоты (v см-1)
|
Изменения в конформации
|
Структурная информация |
Амидные полосы |
||
Амид-I |
Растяжение связи C=O, сопряженное с изгибанием связи N-H
|
Сильная полоса; образование водородных связей ведет к уменьшению частоты полосы амид-I |
1655 ± 5 |
— |
α-спираль (H2O) |
1632 ± 5 |
— |
α-спираль (D2O) |
1670 ± 3 |
— |
Антипараллельный β-лист |
1661 ± 3 |
— |
α-спираль (D2O) |
1655 ± 3 |
— |
Неупорядоченная структура (H2O) |
1658 ± 2 |
— |
Неупорядоченная структура (D2O) |
Амид-III
|
Изгибание связи N-H в плоскости, растяжение связи C-N |
Образование прочных водородных связей увеличивает частоту полосы амид-III
|
>1275 |
— |
α-спираль |
1235±5 |
— |
Антипараллельный β-лист |
983±3 |
— |
Неупорядоченная структура (D2O) |
1245±4 |
— |
Неупорядоченная структура |
Боковые группы аминокислот |
||
Тирозиновый дублет 850/830
|
Резонанс между основными модами кольца и обертонами |
Состояние тирозина |
Триптофан 880-/1361 |
Индольное кольцо |
Окружение кольца триптофана |
Фенилаланин 1006 |
«Дыхание» кольца |
Конформационно нечувствительно |
Гистидин 1409 |
N-дейтероимидазол |
Состояние ионизации гистидина |
|
S-S связь |
|
510 |
Растяжение связи S-S |
Конформационная гетерогенность среди дисульфидов |
525 |
Растяжение связи S-S |
Гош-гош-транс |
540 |
Растяжение связи S-S |
Гош-гош-транс |
|
C-S связь |
|
630-670 |
|
Гош |
700-745 |
|
Транс |
|
S-H связь |
|
2560-2580 |
Растяжение связи S-H
|
Состояние кружения, скорость дейтерирования |
При оценке содержания элементов вторичной структуры в белках, таких как спирали, β-слои и повороты, полоса амид-I анализируется как линейная комбинация спектров белков с известными структурами. Спектры комбинационного рассеяния глобулярных белков в кристаллах и в растворе практически неотличимы, что свидетельствует о природной компактной укладке макромолекул. Поэтому можно использовать информацию о содержании каждого типа вторичной структуры, определенного методом рентгеновской кристаллографии для изучения белков в растворе. Тем же методом удается получить сведения об окружении боковых аминокислотных цепей, а иногда и об их доступности для протонов и дейтеронов.
Очень часто для структурных исследований белков представляет интерес состояние тирозина. Отношение интенсивностей комбинационных полос при 850 и 830 см-1 чувствительно к окружению фенольной OH-группы этой аминокислоты. Своему происхождению дублет полос обязан резонансу между колебаниями фенольного кольца (дыханием) и его обертона. Сильная водородная связь атома водорода фенола по отношению к отрицательно заряженному акцептору обуславливает низкое значение отношения I850/I830 (примерно 3:10), тогда как при связывании водорода с кислородом фенола кислотного донора протона значение для такого же отношения высокое (примерно 10:3).
Одним из примеров подобного подхода может служить исследование погруженных остатков тирозина белка оболочки нитчатого фага fd. Нитчатый фаг fd представляет собой протяженную структуру длиной примерно 895 нм и толщиной около 6 нм. Фаговая частица содержит около 2700 копий белка оболочки, состоящих в основном из α-спиралей.
Два остатка тирозина fd-белка оболочки в положении 21 и 24 могут быть использованы для наблюдения за структурой фага. В спектре комбинационного рассеяния вируса присутствуют несколько пиков, обусловленных этими аминокислотами. Соотношение интенсивностей I850/I830 равно примерно 10:3. Согласно приведенной выше интерпретации, такая пропорция указывает на то, что OH-группы тирозина образуют водородные связи с кислым донором протона. Дальнейшие эксперименты по титрованию показали, что остатки тирозина и их кислотные доноры фага fd недоступны для растворителя. Одно из возможных объяснений этого факта состоит в том, что ОН-группы тирозина служат реципиентами связанных водородной связью протонов достаточно кислых доноров, однако, эти доноры не титруются в диапазоне рН 7-12.
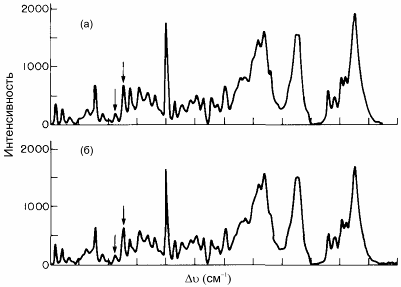
Рис. 59.5 Спектры комбинационного рассеяния fd-фага при рН 8.1 (а) и рН 12.0 (б). Положения двух тирозиновых пиков показаны стрелками. При сравнении интенсивности пиков становится очевидным отсутствие изменений соотношения I850/I830 (Dunkerk A. K. et al. 1979)
Конформационная динамика белков в растворе и кристалле
Благодаря своей хорошо известной структуре инсулин служит привлекательной моделью в исследовании конформационной динамики белков. Макромолекула представляет собой небольшой глобулярный белок из двух цепей А (21 остаток) и В (30 остатков), хранящийся в β-клетках поджелудочной железы в виде гексамера, стабилизируемого ионом Zn2+. Инсулин, выполняющий функцию гормона, является мономером и не содержит иона цинка. Первые кристаллографические исследования проводились на гексамерах инсулина (Рис. 59.6). Использование специально сконструированных мономеров и димеров белка позволяет проводить прямое сравнение его структуры и динамики в различных состояниях самосборки.
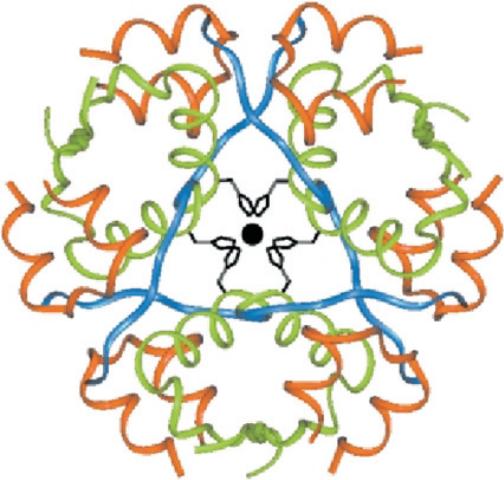
Рис. 59.6. Структура кристалла инсулина Т6 (PDB код 4INS)
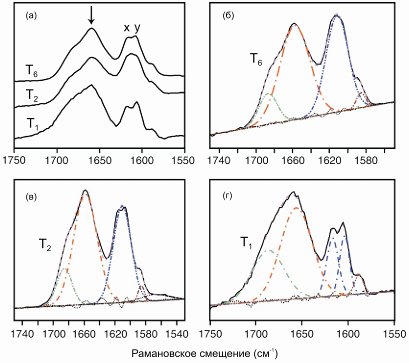
Рис. 59.7. а) Область полосы амид-I спектра комбинационного рассеяния (1550-1750 см-1) водного раствора гексамера инсулина T6, димера T2, и мономера T1. Стрелкой показан максимум полосы амид-I. Экспериментальные данные показаны сплошной черной линией, суммарная аппроксимированная кривая помечена светло фиолетовой пунктирной линией, красная линия точка-пунктир показывает отдельные гауссовы компоненты при 1657 см-1 . (красная). (б)-(г) Разложение полос амид-I при 1611 см-1 (синяя линия), при 1687 см-1 (зеленая) и при 1585 см-1 (коричневая). Пик при 1657 см-1 в полосе амид-I обусловлен вкладом α-спиралей, в то время как плечи около 1680 см-1 - вкладом β-листов и β-слоев. Остатки, принадлежащие неупорядоченным участкам, вносят небольшой вклад при 1648 см-1 и 1678 см-1. Неразрешенный дублет около 1610 см-1 (обозначен как x и y), а также плечо при 1585 см-1 принадлежат колебательным модам колец фенилаланина и тирозина (Dong et al., 2003)
Спектры комбинационного рассеяния раствора гексамера Т6, димера T2, а также мономера T1 в области 1550-1750 см-1 представлены на рисунке 59.7. При переходе от гексамера к мономеру полосы амид-I уширяются, а относительные высоты их пиков изменяются. Значительное увеличение полуширины полосы происходит после диссоциации гексамера T6 (42.9 см-1) до димера T2 (48.7 см-1), а димера до мономера T1 (55.1 см-1). И, наоборот, по мере последовательной сборки комплекса ширина комбинационных полос уменьшается.
Дальнейшее сужение полос, связанных с колебаниями полипептидного остова, наблюдается при формировании волокон. На рисунке 59.8 показан профиль амидных полос волокон инсулина. Полуширина пика при 1673 см-1 сужается до 19.7 см-1. Данные результаты свидетельствуют об определенной подвижности мономера инсулина и ее уменьшении в нативном (гексамер) и патологическом (волокна) состояниях.
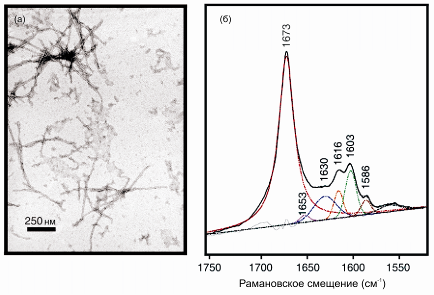
Рис. 59.8 Структура волокон инсулина, полученных при перемешивании белка в растворе, содержащим 60% спирта и 0.25 M NaCl при 35oC. (а) Фотография инсулиновых волокон, сделанная с помощью электронного микроскопа; (б) спектр комбинационного рассеяния волокон, полученный с помощью микроскопа комбинационного рассеяния. Область амид-I может быть представлена суммой полос, основная из которых имеет максимум при 1673 см-1 и двух небольших полос при 1653 см-1 и 1630 cm-1. Пик при 1673 см-1 обусловлен образованием β-листа (Dong et al., 2003)
Дополнительную информацию о конформационной динамике инсулина можно извлечь из исследований одиночного кристалла in situ в висячей капле. Часть спектра комбинационного рассеяния одиночного кристалла инсулина в нативной конформации показана на рис. 59.9(а) и рис. 59.9(в). Спектр одиночного кристалла инсулина Т6 в области полосы амид-I (Рис. 59.9а) чрезвычайно схож с таковым, полученным в растворе (рис 59.7а).
Значительные изменения в спектре комбинационного рассеяния инсулина происходят при добавлении восстанавливающего агента (трис-2-карбоксиэтил-фосфина) к маточному раствору, в котором находится кристалл. Полоса α-спирали при 1657 см-1 (рис. 59.9а) исчезает и вместо нее появляется маркерная полоса одиночного β-листа при 1669 см-1 (рис. 59.9б). Полуширина этой полосы, равная 24 см-1 довольно близка к таковой для волокон инсулина. Эти данные указывают на то, что нативные белки в кристаллическом состоянии также могут претерпевать масштабные превращения в β-листы, аналогично превращениям белка в растворе, как было описано выше. Разворачивание и неправильное сворачивание белка, ведущее к образованию протяженных β-листов, служит причиной амилоидогенных заболеваний. Так, нативные растворимые белки частично разворачиваются и агрегируют, вероятно используя остаточный домен «β-лист» как ядро нуклеации. Это приводит к амилоидному фибрилогенезу и, как следствие, образованию нерастворимых волокон.
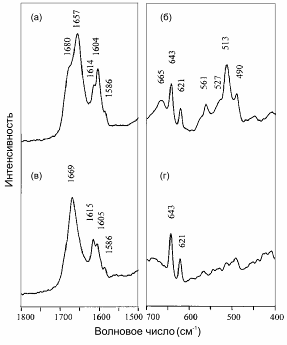
Рис. 59.9. Часть спектра комбинационного рассеяния одиночного кристалла инсулина, полученного с помощью рамановского микроскопа: спектр нативного белка в кристалле (вверху) и спектр β-трансформированного белка в кристалле после добавки восстанавливающего агента трис-2-карбоксиэтил-фосфина к маточному раствору (внизу). Пики при 1615 и 1643 см-1 принадлежат тирозиновым модам, а пики при 1604 и 1621 см-1 – модам фенилаланинового кольца. Считается, что моды кольца претерпевают небольшие изменения в интенсивности при изменении вторичной структуры и поэтому служат стандартами интегральной интенсивности (Zheng et al., 2004)
