
- •Цитоплазма: утворення білків - трансляція, фолдинг, модифікація
- •3.1 Вступ
- •3.2. Трансляція мРнк
- •3.2.1. Підготовчі стадії. Центри рибосом.
- •3.2.1.1. Зв’язування амінокислот з тРнк
- •3.2.1.2. Функціональні центри рибосом
- •3.2.1.3. Ініціація трансляції
- •3.2.2. Елонгація і термінация трансляції
- •3.2.2.1. Стадії елонгації
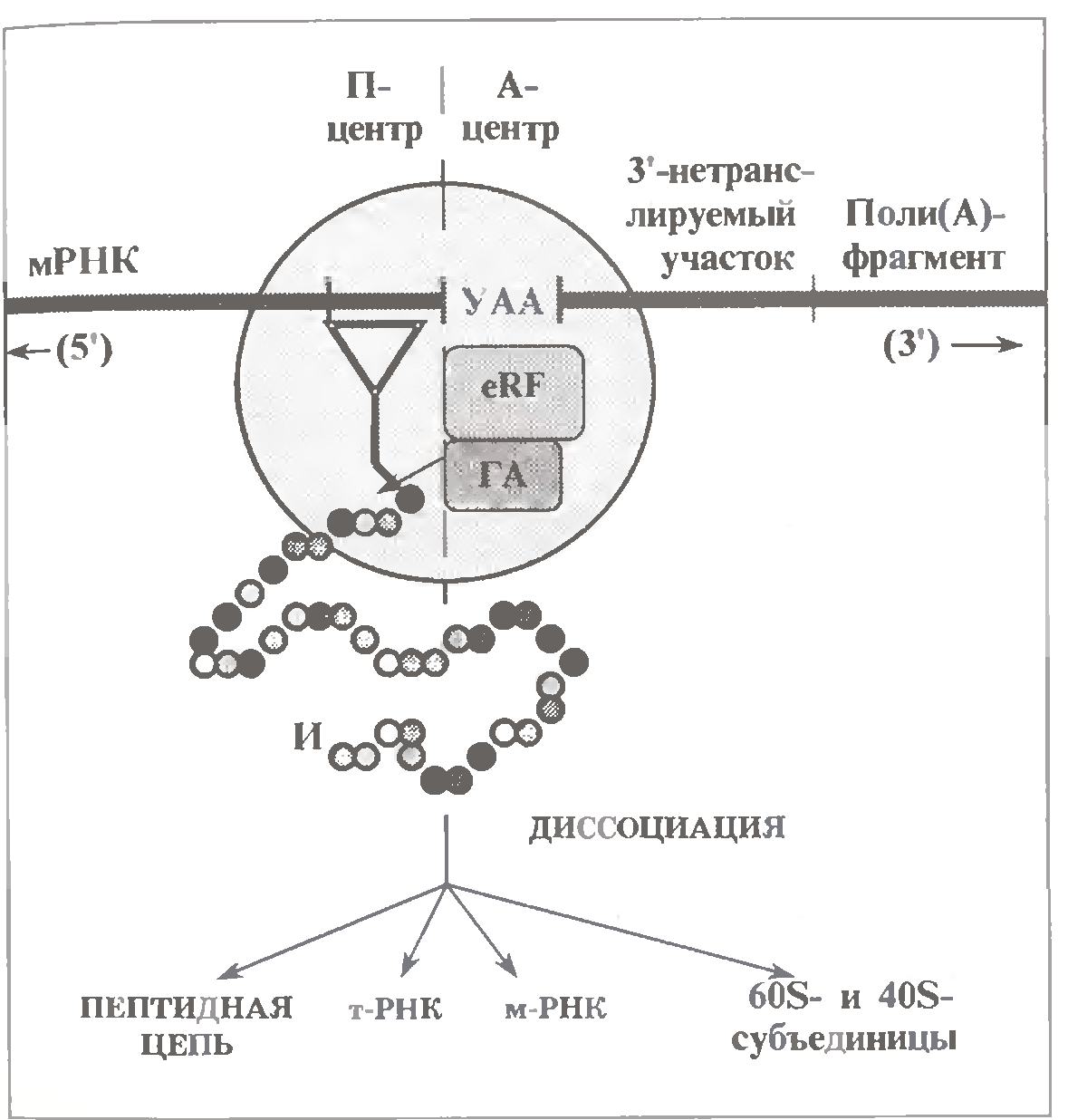
- •3.2.2.2. Термінація трансляції
- •3.2.3 Полісоми
- •3.2.4. Особливості трансляції у прокаріот і в мітохондріях
- •3.2.4.1. Прокаріоти
- •3.2.4.2. Мітохондрії
- •3.3. Інгібітори трансляції
- •3.3.1. Інгібірування трансляції у бактерій
- •3.3.2. Інгібірування трансляції у еукаріот
- •3.3.2.1. Антибіотики
- •3.3.2.2. Дифтерійний токсин
- •3.3.2.3 Інтерферони
3.2.1.3. Ініціація трансляції
(мал.
3.5)
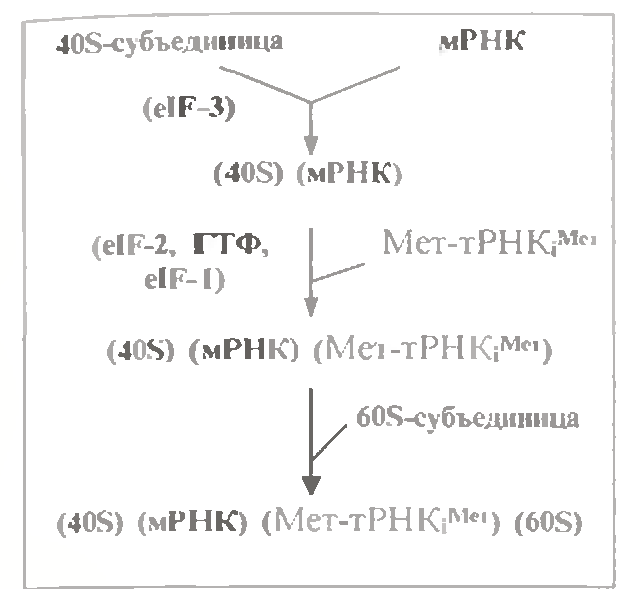
Передусім відбувається зв'язування мРНК (своєю 5'-нетрансльованою ділянкою) з малою (40S -) субодиницею рибосоми. При цьому кодон (АУГ), що ініціює, виявляється на рівні П-центру майбутньої рибосоми.
Далі за рахунок взаємодії комплементу з цим кодоном відбувається зв'язування ініціюючої аа-тРНК, тобто Мет - тPHKjмет.
А остання, взаємодіючи з П-центром великої субодиниці, викликає зв'язування і цієї субодиниці.
Таким чином, формується своєрідний "бутерброд" з чотирьох основних компонентів.
Проте, окрім їх, для ініціації трансляції необходні і інші учасники - ГТФ і три білкові чинники - eIF - 1, eIF - 2 і eIF -3 (від eucariotic initiation factor).
З них фактор eIF -3 приєднуючись до вільної малої субодиниці рибосоми, перешкоджає передчасному зв'язуванню великої субодиниці і, навпаки, сприяє зв’язуванню мРНК.
Інший чинник - eIF - 2 - бере участь у зв’язуванні ініціюючої аа-тРНК. Можливо, цей білок утворює комплекс з цією аа-тРНК ще поза рибосомою, причому до складу комплексу входить і ГТФ.
Потім - в процесі установки Мет - тPHKjмет на своє місце в П-центрі і зв'язування великої субодиниці - ГТФ гідролізується до ГДФ і неорганічного фосфату. Одночасно чинники eIF -3 і eIF - 2 покидають рибосому.
Таким чином, зборка активної рибосоми йде з розривом одного макроергічного зв'язку. Енергія, що виділяється при цьому, створює термодинамічний стимул для протікання процесу в потрібному напрямі.
Що стосується чинника eIF - 1, то він, мабуть, сприяє новій "зарядці" чинника eIF - 2 шляхом приєднання до нього чергових молекул ГТФ і Мет - тPHKjмет.
У результаті ініціації трансляції в П-центрі зібраної рибосоми виявляються кодон мРНК (АУГ), що ініціює, і пов'язана з ним ініціююча аа-тРНК.
Остання при утворенні першого пептидного зв'язку грає роль пептидил-тРНК.
3.2.2. Елонгація і термінация трансляції
Після ініціації починається основний етап трансляції процес елонгації (подовження пептидного ланцюга).
Він має циклічний характер: включення кожної настукної амінокислоти відповідає один і той же цикл подій - незалежно від того, скільки амінокислотних залишків вже знаходиться в пептидному ланцюзі - тільки один (як відразу після ініціації) або вже більше сотні.
3.2.2.1. Стадії елонгації
У циклі елонгації розрізняють 3 стадії.
Ілюструючи їх (мал. 3.6), ми знову проектуватимемо учасників подій на умовну площину між субодиницями рибосоми.
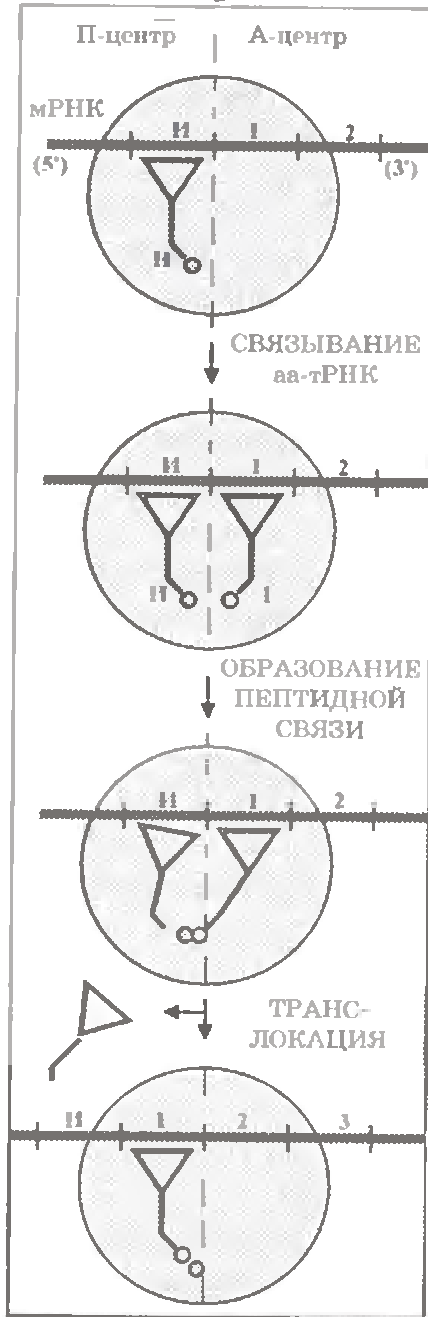
При цьому, для спрощення, П-центром ми називатимемо усю ліву (на малюнку) половину круга, а А-центром - усю праву половину. Тобто до складу цих центрів включатимемо і прилягаючі ділянки М- і ПТФ-центрів.
а) Зв'язування аа-тРНК. На першій стадії циклу з вільним А-центром рибосоми зв'язується чергова аа-тРНК - та, чий антикодон комплементарний кодону мРНК, що знаходиться в А-центрі.
У загальних рисах це відбувається приблизно так само, як зв'язування ініціаторної аа-тРНК з П-центром. Тобто теж використовуються молекула РГФ і два білкові чинники - фактори елонгації EF - 1u і EF - ls (від elongation factor).
Чинник EF - 1u (подібно до чинника eIF - 2) утворює комплекс з ГТФ і з проникаючою в рибосому черговою аа-тРНК.
Якщо антикодон цій аа-тРНК не комплементарний кодону мРНК в А-центрі, комплекс не затримується тут і шляхом дифузії покидає рибосому.
У разі ж взаємодії комплементу антикодону з кодоном, вищезгаданий комплекс розпадається: його аа-тРНК зв'язується з А-центром, ГТФ гідролізується до ГДФ, і останній вивільняється разом з чинником EF - lu.
Потім EF - lu, за участю фактора EF - ls (подібного до чинника eIF - 1), поза рибосомою обмінює ГДФ на ГТФ і зв'язує чергову молекулу аа-тРНК.
б) Замикання пептидного зв'язку.
У рибосомі ж після першої стадії циклу виявляються один біля одного пептидил-тРНК (у П-центрі) і аа-тРНК (у А-центрі). Причому їх акцепторні петлі і пов'язані з ними амінокислотні залишки розташовуються в каталітичному (ПТФ -) центрі.
Останній і здійснює пептидилтрансферазну (ПТФ) реакцію - переносить пептидил (або ініціюючу амінокислоту) з його тРНК на амінокислоту аа-тРНК.
Відмітимо: з тРНК амінокислотний залишок пов'язаний за допомогою своєї карбоксильної групи (мал. 3.7).
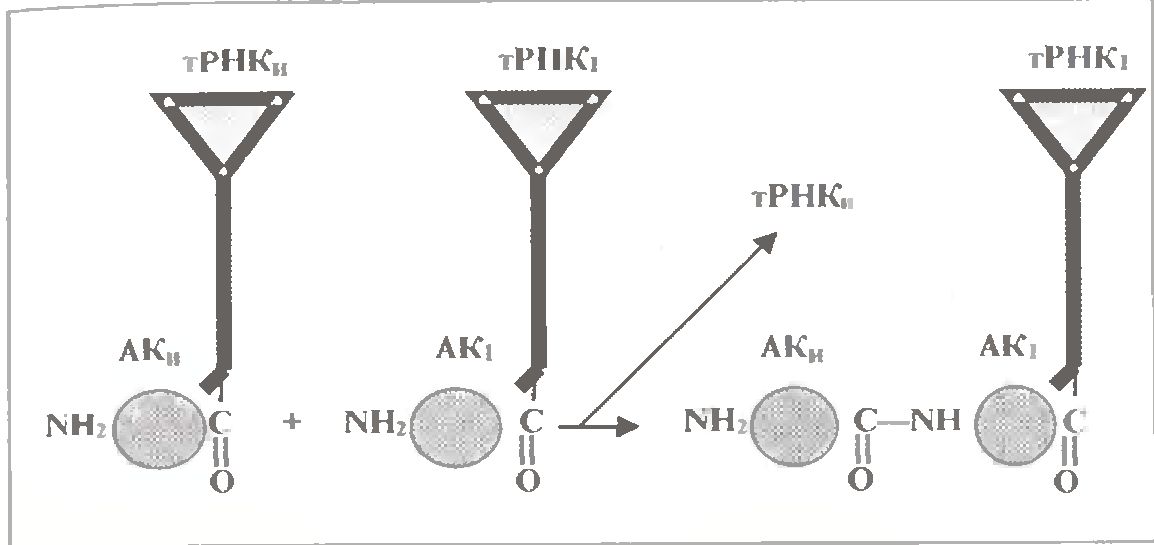
У ході ж ПТФ-реакції ця група пептидила утворює пептидний зв'язок з аміногрупою чергової амінокислоти. Отже, кінець аміну (N-) пептидила залишається інтактним.
Це означає, що зростання пептидного ланцюга при трансляції відбувається в напрямі від N- до С-кінця.
ПТФ-реакція супроводжується виділенням деякої кількості енергії. Тому ГТФ як джерело енергії не вимагається.
Не вимагаються і які-небудь додаткові білкові фактори.
В результаті ПТФ реакції пептидил подовжується на один амінокислотний залишок і виявляється пов'язаним через цей залишок з іншою тРНК. При цьому антикодонова петляи цієї тРНК ще знаходиться в А-області рибосоми, а акцепторна петля разом з пептидилом, можливо, виявляється в ході реакції в П-центрі (А/П-орієнтація).
Це може бути причиною створення стеричної напруги.
Колишня ж тРНК пептидила стає вільною: її "голова" (антикодонова петля) ще знаходиться в П-центрі, а звільнена - "хвіст" (акцепторна петля) релаксує убік Е (ехit) -ділянки П-центру (П/Е-орієнтація).
в) Транслокація (см. рис. 3.6). Завершуюча стадія цикла - переміщення (транслокація) мРНК разом зі знову утвореним пептидил-тРНК відносно рибосоми на довжину одного кодону.
Або можна сказати, що рибосома переміщується відносьно мРНК - у напрямі її 3'-конца.
Рушійною силою транслокації може бути стерична напруга в структурі нової пептидил-тРНК. "Хвіст" (пептидил, зафіксований в П-центрі) втягує в П-центр і "голову" (тРНК). А оскільки остання пов'язана з кодоном мРНК, то і мРНК теж переміщається відносно рибосоми.
У процесі беруть участь ГТФ і білковий чинник елонгації EF-2, названий також транслоказою. Не виключено, що вирішальну роль в створенні "тяги" грає стерична напруга не в пептидил-тРНК, а в транслоказі, створюване за рахунок енергії ГТФ.
Як би то не було, в результаті транслокації в П-центрі рибосоми опиняються нові пептидил-тРНК і відповідний їй кодон мРНК. тРНК, що звільнилася, витісняється з рибосоми.
Що ж до А-центра, то він містить тепер наступний кодон мРНК і готовий до прийому нової аа-тРНК.
На цьому цикл елонгації закінчується і починається черговий цикл. Як бачимо, подовження пептидного ланцюга на один амінокислотний залишок вимагає витрати 2 молекул ГТФ (по одній - на зв'язування аа-тРНК і на транслокацію).
Багатократне повторення таких циклів і призводить до включення в пептидний ланцюг амінокислотних залишків, у відповідності з послідовністю кодонів в мРНК.
