
- •Цитоплазма: утворення білків - трансляція, фолдинг, модифікація
- •3.1 Вступ
- •3.2. Трансляція мРнк
- •3.2.1. Підготовчі стадії. Центри рибосом.
- •3.2.1.1. Зв’язування амінокислот з тРнк
- •3.2.1.2. Функціональні центри рибосом
- •3.2.1.3. Ініціація трансляції
- •3.2.2. Елонгація і термінация трансляції
- •3.2.2.1. Стадії елонгації
- •3.2.2.2. Термінація трансляції
- •3.2.3 Полісоми
- •3.2.4. Особливості трансляції у прокаріот і в мітохондріях
- •3.2.4.1. Прокаріоти
- •3.2.4.2. Мітохондрії
- •3.3. Інгібітори трансляції
- •3.3.1. Інгібірування трансляції у бактерій
- •3.3.2. Інгібірування трансляції у еукаріот
- •3.3.2.1. Антибіотики
- •3.3.2.2. Дифтерійний токсин
- •3.3.2.3 Інтерферони
Цитоплазма: утворення білків - трансляція, фолдинг, модифікація
3.1 Вступ
а) В минулій главі ми розглянули синтез і дозрівання в клітинних ядрах трьох видів РНК.
При цьому, як було сказано, 4 види рРНК тут же в ядрі (а точніше, в ядерцях) об'єднуються з рибосомальними білками, формуючи субодиниці рибосом. Ці субодиниці через ядерні пори переміщуються в цитоплазму.
Туди ж переміщуються і численні мРНК (у комуплексі із спеціальними білками), а також тРНК (декількох десятків видів).
З іншого боку, в цитоплазмі присутні 20 видів амінокислот (синтезованих в самій клітині або таких, що надійшли з крові).
Нарешті, тут же знаходяться 20 видів ферментів аміно-ацил-тРНК синтетаз (п. 2.5.3.2) - і додаткові білкові чинники
Усі ці речовини беруть участь в трансляції - послідовному включенні амінокислот в пептидні ланцюги, що будуються, відповідно до послідовності кодонів в мРНК (п. 2.1).
б) Але і після закінчення трансляції процес утворення білків зазвичай ще не завершений. Так, потім відбуваються:
фолдинг, тобто згортання пептидного ланцюга в просторову структуру;
а у разі більшості білків ще і модифікація (наприклад, приєднання вуглеводних компонентів, окислення певних амінокислотних залишків і т. д.).
Для усього цього також потрібні спеціальні білки, в т. ч. ферменти. Зокрема, досягнення білком правильної конфігурації в ході фолдинга значно прискорюється нещодавно відкритими допоміжними білками - шаперонами
в) Нарешті, останнє важливе завдання - забезпечити доставку білку до місця його майбутнього функціонування. Для цього теж існують спеціальні механізми. Причому вирішення цієї проблеми починається ще з трансляції.
Т. з. "експортні" (призначені до виділення з клітини), мембранні і лізосомальні білки утворюються мембранозв’язанними рибосомами, тобто рибосомами, прикріпленими до поверхні мембран ендоплазматичної мережі (ЕПС) Завдяки цьому кінець пептиду, що синтезується, проникає у внутрішній простір ЕПС, де потім виявляється і увесь білок.
У цьому ж просторі, отже, відбуваються потім фолдинг і модифікація цього білку.
Далі в транспорті і модифікації беруть участь інші мембранні структури, і передусім, апарат Гольджи.
Кінець кінцем білок
- або виділяється в ході екзоцитозу з клітини
- або включається до складу тієї або іншої мембрани
- або залишається усередині лізосоми, що сформувалася.
На відміну від цього, внутрішні білки (білки гіалоплазми, мітохондрій, ядра і т. д.) синтезуються на вільних, тобто мембранозв’язанних, рибосомах.
В цілому, підводячи підсумок ввідному огляду, можна зробити таке порівняння.
Як в пологах і вихованні однієї людини бере участь немало інших людей, так і в утворенні і дозріванні будь-якого білку бере участь багато інших білків, не кажучи про нуклеїнові кислоти і інші речовини; і усі вони входять в складну і добре відлагоджену "виробничу" систему.
Тепер детальніше розглянемо окремі "вузли" цієї системи.
3.2. Трансляція мРнк
3.2.1. Підготовчі стадії. Центри рибосом.
3.2.1.1. Зв’язування амінокислот з тРнк
В трансляції беруть участь не вільні амінокислоти, а аміноцил-тРНК (аа-тРНК): ала-тРНКала, мет-Трнкмет і т.д. для всіх амінокислот. Кожна амінокислота зв’язана з акцепторною петлею своєї тРНК.
Утворення аа-тРНК це не просто активація амінокислот, тобто підвищення її реакційної здатності. В даному процесі вирішується важливе завдання – спряження амінокислоти з її антикодоном.
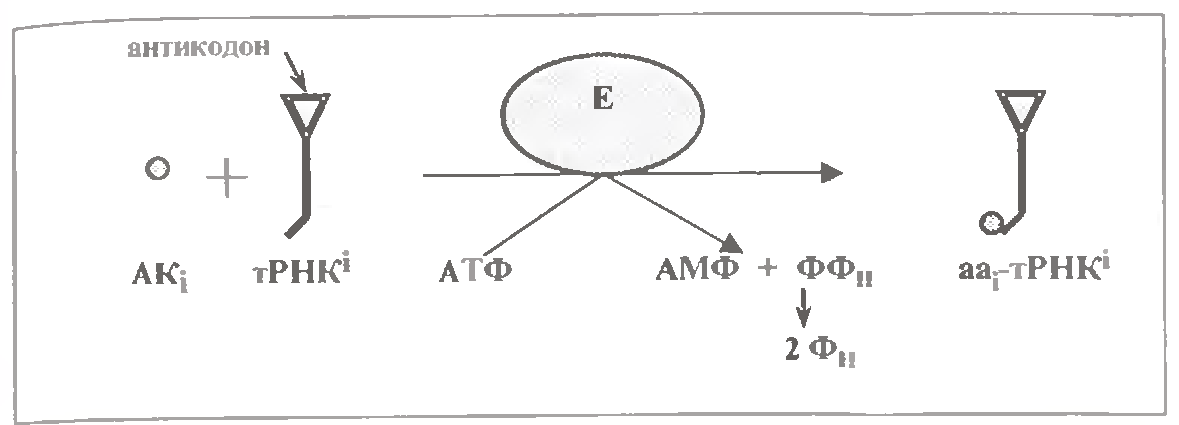
Ключову роль в правильному зв'язуванні відіграють специфічні ферменти - аміноацил-тРНК-синтетази (п. 2.5.3.2), і для виконання цієї ролі вони повинні мати по 2 центри упізнавання - для амінокислоти і для тРНК.
Існує ще одна проблема: взаємодія амінокислоти з тРНК стикається з енергетичним бар'єром. Для подолання останнього використовується молекула АТФ. Тому реакція йде в дві стадії:
- спочатку амінокислота зв'язується з аденілатом
- і лише потім переноситься на тРНК.
Обидві стадії проходять в активному центрі аміноацил-тРНК-синтетази.
Кожна молекула тРНК може використовуватися як "носій" амінокислоти багаторазово. Іншими словами, звільнившись в процесі трансляції від попередньої молекули амінокислоти, тРНК стає здатною зв'язувати (за допомогою аміноацил-тРНК-синтетази) чергову молекулу того ж виду амінокислот.
А чи може молекула амінокислоти кілька разів брати участь в реакції зв'язування з тРНК? В принципі - так, але в цьому випадку цикл складніший. Необхідно, щоб білок, в який була включена ця молекула амінокислоти, "відпрацював" свій термін, зруйнувався і дана молекула знову потрапила в пул використовуваних для трансляції амінокислот.
