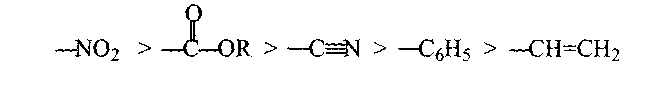- •Йонна полімеризація план
- •Відмінності йонної полімеризації від радикальної
- •Кінетичні особливості йонної полімеризації
- •Аніонна полімеризація вінілових мономерів
- •Карбаніони та їхні властивості
- •Ініціювання аніонної полімеризації
- •Аніонна полімеризація неполярних мономерів
- •Синтез за допомогою живих полімерів
- •Аніонна кополімеризація
- •Катіонна полімеризація вінілових мономерів
- •Катіонна полімеризація вінілових етерів
- •Полімеризація діазосполук
- •Катіонна кополімеризація вінілових мономерів
- •Йонна полімеризація сполук з кратним зв'язком між гетероатомами
- •Йонна полімеризація гетероциклічних мономерів
Карбаніони та їхні властивості
Карбаніони - заряджені частинки, які містять атом вуглецю з неподіленою парою електронів. Цей атом з'єднується з іншими атомами трьома -зв'язками або - та -зв'язками. Біля негативно зарядженого атома вуглецю замісники можуть розташовуватись як в одній площині, так і в кутах тригранної піраміди, вершиною якої є атом С-.
За
відсутності стеричних перешкод
алкілзаміщені карбаніони мають
пірамідальну
структуру, і заряджений атом вуглецю
перебуває в sр3
-гібридизованому стані. Такі аніони
хіральні, враховуючи, що неподілена
пара електронів є четвертим замісником,
але енергетичний бар'єр взаємопереходу
енантіомерів настільки малий, що існувати
в індивідуальному стані вони
не можуть і перебувають у динамічній
рівновазі.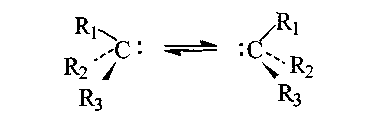
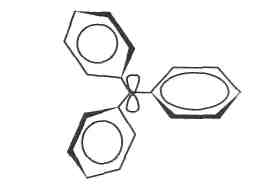
Фенільні ядра у цьому аніоні завдяки стеричним умовам утворюють "пропелер" з кутом 30°.
Найпоширеніші сполуки, до складу яких входять карбаніони - металоорганічні. Металоорганічні сполуки - це і ініціатори аніонної полімеризації, і макромолекули, що ростуть. Як відзначалося вище, їх можна розглядати як солі С-Н-кислот, тобто вуглеводнів та їхніх похідних. Металоорганічні сполуки у розчинах можуть дисоціювати за зв'язком С-Ме, утворюючи карб аніони
![]()
Дисоціація тим більша, чим більш делокалізований заряд на карбаніоні і чим менший потенціал йонізації металу Ме. Велике значення також має і розчинник: чим більша його здатність до сольватації йонів та чим більша діелектрична проникність, тим більша константа дисоціації.
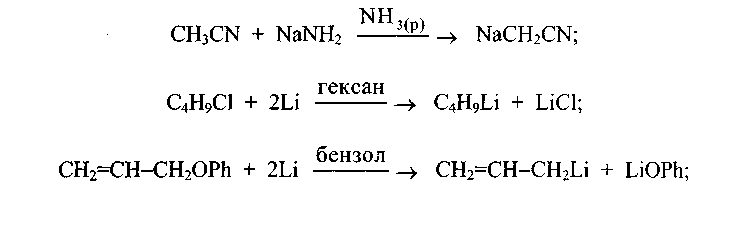
Розроблено багато методів синтезу металоорганічних сполук, наприклад:
Як уже згадувалося вище, дисоціація металоорганічних сполук проходить через декілька стадій у рівновазі з йонними парами. Йонні пари не можуть бути зафіксовані вимірюванням електропровідності, але мають чіткі максимуми зв'язаних карбаніонів в електронних спектрах, що дає змогу їх якісно й кількісно фіксувати.
Електронна спорідненість вуглецю невелика, тому відносна стабільність карбаніонів і кислотність відповідних С-Н-кислот тим більша, чим більше делокалізований на ньому негативний заряд. Висока стабільність у ароматичних багатоядерних конденсованих аніонів, наприклад, флуоренілу
![]()
Найбільший ефект збільшення кислотності вуглеводнів спостерігається у разі введення в їхні молекули електронно-акцепторних груп. Введення в ядро толуолу нітрогрупи збільшує його константу дисоціації на 20 порядків і більше. Приблизно такий самий ефект викликає заміна водню у метильному радикалі толуолу на СN-групу, а після введення другої СN-групи утворюється кислота (фенілмалоно-динітрил), яка за силою близька до карбонової. Така висока кислотність пов'язана зі стабілізацією відповідного аніона внаслідок делокалізації від'ємного заряду, що ілюструється граничними структурами.
Карбаніони можна розкласти у таку послідовність збільшення стабільності і зменшення активності
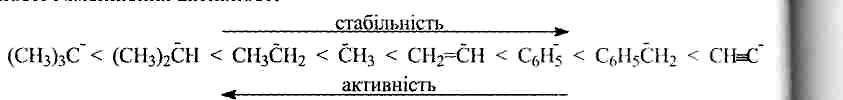
Замісники, які стабілізують карбаніони, утворюють таку послідовність: