
- •Йонна полімеризація план
- •Відмінності йонної полімеризації від радикальної
- •Кінетичні особливості йонної полімеризації
- •Аніонна полімеризація вінілових мономерів
- •Карбаніони та їхні властивості
- •Ініціювання аніонної полімеризації
- •Аніонна полімеризація неполярних мономерів
- •Синтез за допомогою живих полімерів
- •Аніонна кополімеризація
- •Катіонна полімеризація вінілових мономерів
- •Катіонна полімеризація вінілових етерів
- •Полімеризація діазосполук
- •Катіонна кополімеризація вінілових мономерів
- •Йонна полімеризація сполук з кратним зв'язком між гетероатомами
- •Йонна полімеризація гетероциклічних мономерів
Йонна полімеризація гетероциклічних мономерів
Полімеризація з розкриттям циклу є одним з найважливіших методів синтезу полімерів. Як правило, вона проходить за йонним або координаційним механізмами.
Аніонна полімеризація оксиду етилену.
Серед циклічних етерів лише епоксиди (оксирани, -оксиди, циклічні оксиди) здатні до аніонної полімеризації. Найкраще цей процес вивчений для найпростіших епоксидів — оксидів етилену та пропілену. Саме ці гетероцикли є багатотоннажними продуктами хімічної промисловості, значну частину яких використовують у синтезі полімерів.
Здатність утворення оксидом етилену олігомерів під впливом речовин різної природи була відома ще наприкінці позаминулого століття, але перші скеровані дослідження полімеризації цього мономера були здійснені Штаудінгером лише у 1930-х роках. Він довгий час витримував мономер з різними ініціаторами у запаяних трубках при 20 °С.
Штаудінгер майже одночасно з високомолекулярним полімером формальдегіду одержав високомолекулярний поліетиленоксид. І знову ці дослідження лягли в основу розроблення промислової технології - наприкінці 1950-х років американська фірма "Юніон карбайд" розпочала випуск високомо-лекулярного поліетиленоксиду під назвою "поліокс". Ініціаторами аніонної полімеризації циклічних оксидів можуть бути луги та алкоголяти лужних металів, комплекси лужних металів з нафталіном, деякі металоорганічні сполуки, аміди, оксиди та солі лужноземельних металів.
Аніонна полімеризація оксиду пропілену.
У заміщених епоксидах розкриття циклу може проходити за правилом Красуського або з його порушенням. Професор Київського політехнічного інституту Костянтин Адамович Красуський (1867-1937) встановив це правило у 1911 році. За цим правилом епоксидний цикл під впливом різних сполук (вода, аміак) у нейтральному середовищі або у присутності лугів розкривається між атомом кисню та менш заміщеним атомом вуглецю (р-атомом).
Аніонною полімеризацією оптично активного оксиду пропілену у присутності КОН одержали оптично активний олігомер, який зберігав знак обертання мономера. Це означає, що розкриття циклу проходить виключно з розривом зв'язку С-О біля р-атома оксиду. Аніонна полімеризація оксиду пропілену та інших заміщених епоксидів ускладнюється не лише міжланцюговим обміном, але й передаванням ланцюга на мономер. Утворений алкоголят алілового спирту ініціює новий ланцюг, в якому з'являється кінцева ненасичена група. Саме цей процес є основною перешкодою у виробництві поліпропіленгліколів - біфункціональних реакційно-здатних олігомерів оксиду пропілену. Поліпропіленгліколі - багатотоннажні продукти хімічної промисловості -випускають з молекулярними масами від 400 до 4000 (торгова марка "лапрол"). Являють собою прозорі в'язкі рідини. На відміну від ПЕГ, не мають іншого застосування, крім виробництва м'яких поліуретанів.
Катіонна полімеризація циклічних етерів.
До катіонної полімеризації здатні циклічні етери з кількістю атомів у циклі (п) від 3 до 6 (цифри під формулами мономерів відповідають енергії напруженості циклу):
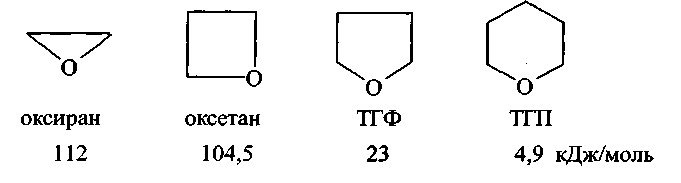
Активними центрами полімеризації тут є йони позитивно зарядженого тривалентного атома кисню – оксонію (R)3 O+.
Такі йони виникають при ініціюванні полімеризації як протонними кислотами, так і кислотами Льюїса.
Низькоплавкі олігомерні фотонапівпровідники, які використовують для запису голограм, вперше синтезували на кафедрі хімії мономерів та полімерів Київського університету імені Тараса Шевченка у 1972 році. Катіонною полімеризацією гліцидилкарбазолу (ГК) одержали олігогліцидилкарбазол (ОГК) ОГК топиться при 75-80 °С і утворює плівки з толуольних розчинів. За присутності сенсибілізаторів фотоефект у ньому викликає видиме світло. Плівка ОГК у темряві - діелектрик і зберігає поверхневий заряд, нанесений на неї. При експонуванні у місцях потрапляння світла заряд стікає. Утворюється приховане електростатичне зображення, яке проявляють імпульсним нагріванням понад температуру топлення плівки. Поверхневий заряд, що залишився в неосвітлених місцях, деформує плівку, утворюючи рельєфне зображення. Повторне нагрівання миттєво його стирає. "Запис-стирання" займає мілісекунди, тобто відбувається у реальному масштабі часу, і має назву фототермо-тастичний запис інформації (ФТПЗ). ОГК (під назвою ПЕПК - поліепокси-пропілкарбазол) та политі ним плівки для ФТПЗ випускали в СРСР у промислових кількостях. Нині в Україні на основі таких плівок виробляють рельєфні голограми для захисту цінних паперів та товарних знаків.
Подальші роботи у цій царині дали нам змогу одержати фоточутливі олігомери гліцидилових етерів та естерів. Ці мономери розкладаються під дією лугів, їх можна полімеризувати лише за катіонним механізмом.
Полімеризація циклічних ацеталів.
Циклічні ацеталі полімеризуються винятково за катіонним механізмом. Найбільше значення серед них мають тример формальдегіду триоксан та циклічний формаль діоксолан:

Триоксан є промисловим мономером для синтезу поліформальдегіду, причому для стабілізації полімеру можна додавати від 1 до 15 % діоксолану (целкон). Навіть коли поліформальдегід одержують безпосередньо з мономера, триоксан та циклічний тетрамер - тетраоксан беруть участь у полімеризації завдяки рівновазі. Практично полімеризація формальдегіду чи триоксану завжди є кополімеризацією, як мінімум, трьох мономерів (відомо, що рівноваги також встановлюються з циклами більшого розміру).
Полімеризація етиленіміну
Серед гетероциклів, що містять імінну групу, найбільше значення має етиленімін - високотоксична рідина (Т кип. 57 °С) з запахом аміаку. Етиленімін -сильна основа (вторинний амін), а тому не здатний до аніонної полімеризації. Полімеризується у присутності протонних та апротонних кислот, вуглекислоти, алкілгалогенідів та диметилсульфату.
Високомолекулярний поліетиленімін можна одержати у присутності епіхлоргідрину, органічних дигалогенідів або поліакрилової кислоти. Виробництво поліетиленіміну розпочалося у 1938 році, і він широко застосовується у техніці, насамперед у вигляді невеликих допоміжних добавок у різних технологічних процесах, наприклад, для руйнування емульсій та суспензій, для підвищення адгезії між неполярними та полярними компонентами різних композицій, для розчинення оксидів, карбонатів та інших нерозчинних сполук металів. Це одна з найсильніших полімерних основ. Без полімерів та олігомерів етиленіміну неможливий сучасний технологічний процес виготовлення паперу, де вони є багатоцільовими агентами, що прискорюють зневоднення паперової маси, зменшують витрати різних видів сировини та є ефективними агентами водоочищення. На основі поліетиленіміну створені найефективніші аніоніти.
Полімеризація лактонів
Циклічні етери - лактони - здатні розкриватися як кислими, так і основними реагентами, тому полімеризуються як за катіонним, так і за аніонним механізмами. 4-членний пропіолактон легко полімеризується за кімнатної температури у присутності кислот. Усі полілактони є аліфатичними поліестерами. З них можна формувати волокна та плівки.
Полімеризація лактамів
Лактами, як і лактони, здатні до катіонної та аніонної полімеризації.
Катіонна полімеризація лактамів проходить у присутності протонних кислот та кислот Льюїса. Як не дивно, але катіонну полімеризацію лактамів здатні викликати аміни.
Широко відомий полімер капролактаму - капрон (найлон 6) вперше почали випускати у Німеччині у 1941 році під назвою перлон, звідки після Вітчизняної війни устаткування з його виробництва та технологія були переведені у СРСР як репарації. Один з заводів перенесли до Києва, він і став основою Дарницького шовкового комбінату (ДШК).
Головний спосіб одержання капрону - гідролітичний (під впливом води). З цього полімеру формують волокно. У машинобудуванні (шестерні, втулки, вкладиші для підшипників) використовують міцніший капролон (капроліт) -полімер капролактаму, одержаний аніонною полімеризацією. Полікапролактам -представник великого класу полімерів - поліамідів, більшу частину яких отримують поліконденсацією.
Полімеризація циклічних силоксанів
Кремнійорганічні полімери - полісилоксани (силікони) - вперше одержав у 1937 році науковий працівник Всесоюзного електротехнічного інституту (м. Москва), майбутній академік Кузьма Андріанович Андріанов (1904-1978), який віддав цим важливим матеріалам усе своє життя. Він розробив способи синтезу вихідних мономерів та створив технологію промислового виробництва полісилоксанів.
Одним з головних методів одержання силоксанових олігомерів та полімерів, (асортимент їхній величезний: американська фірма Dow Korning, наприклад, випускає понад 2000 назв цієї продукції) є полімеризація циклосилоксанів. Катіонна полімеризація циклосилоксанів відбувається у присутності сильних протонних кислот та кислот Льюїса, причому активні центри утворюються під час електрофільної атаки атома кисню.
Головна властивість олігомерних силоксанів - рідкий стан у широкому інтервалі температур - від -120 до +350 °С. Це визначило коло їхнього застосування як рідких робочих середовищ для різних приладів та механізмів, гідравлічних рідин та теплоносіїв. За допомогою цих олігомерів можна надати різним матеріалам гідрофобних властивостей. Олігоорганосилоксани унікальні піногасники, які дають змогу знищувати піну у багатьох видах виробництва, наприклад, у виробництві ліків, цукроварінні, виноробстві. Цю властивість олігомерних силіконів використовують при складних хірургічних операціях, коли з організму тимчасово виводиться значна частина крові.
Найпоширенішим силоксановим каучуком є полідиметилсилоксан, що містить від 0,1 до 1 % метилвінілсилоксанових ланок для полегшення вулканізації Головною особливістю силоксанових каучуків є поєднання високої теплостійкості (до 300 °С) з високою морозостійкістю (від -60 до -130 °С) залежно від замісника - органічного радикала.
