
- •Глава 10 галогенопохідні вуглеводнів
- •10.1. Номенклатура
- •10.2. Ізомерія
- •10.3. Галогеналкани
- •10.3.1. Способи добування
- •10.3.2. Фізичні властивості
- •Фізичні константи деяких галогеналканів
- •10.3.3. Хімічні властивості
- •10.4. Дигалогеналкани
- •10.4.1. Способи добування
- •10.4.2. Хімічні властивості
- •10.5.Галогеналкени
- •10.5.1. Способи добування
- •10.5.2. Хімічні властивості
- •10.6. Ароматичні галогенопохідні
- •10.6.1. Способи добування
- •10.6.2. Фізичні властивості
- •10.6.3. Хімічні властивості
- •10.7. Ідентифікація галогенопохідних вуглеводнів
- •10.7.1. Хімічні методи
- •10.7.2. Інструментальні методи
- •10.8. Окремі представники галогенопохідних вуглеводнів
- •Контрольні питання та вправи
10.4. Дигалогеналкани
Дигалогеналкани містять у своєму складі два атоми галогену. Атоми галогенів можуть знаходитись біля того самого атома вуглецю (гемінальні дигалогеналкани), біля сусідніх атомів вуглецю (віцинальні дигалогеналкани) або розділені декількома вуглець-вуглецевими зв'язками.
10.4.1. Способи добування
Приєднання галогеноводнів до алкінів (див. с. 62). В результаті реакції утворюються гемінальні дигалогеналкани:

Взаємодія альдегідів і кетонів з пентагалогенідами фосфору (РСl5, РВr5). У процесі реакції утворюються гемінальні дигалогеналкани:


Приєднання галогенів до алкенів (див. с. 35). У результаті реакції утворюються віцинальні дигалогеналкани:

10.4.2. Хімічні властивості
Хімічні властивості дигалогеналканів аналогічні властивостям моногалогеналканів. Вони вступають у різні реакції нуклеофільного заміщення та відщеплення, властиві галогеналканам.
Так, при лужному гідролізі дигалогеналканів, у котрих атоми галогену знаходяться при різних атомах вуглецю, утворюються двоатомні спирти — гліколі:

У присутності спиртових розчинів лугів при нагріванні гемінальні та віцинальні дигалогеналкани піддаються елімінуванню з утворенням алкінів:


Поряд з цим гемінальні дигалогеналкани в хімічній поведінці мають деякі особливості.
При лужному гідролізі вони утворюють альдегіди або кетони:
10.5.Галогеналкени
Галогеналкенами називають похідні алкенів, у яких один або
декілька атомів водню заміщені атомами галогенів.
За взаємним розміщенням подвійного зв'язку і атома галогену галогеналкени можна умовно розділити на три групи:

1. Вінілгалогеніди — сполуки, що містять атом галогену біля вуглецю, який утворює подвійний зв'язок:

2. Алілгалогеніди — сполуки, в яких атом галогену знаходиться в α-положенні до вуглецю, що утворює подвійний зв'язок:

3. Сполуки, в яких атом галогену і атом вуглецю, що утворює подвійний зв'язок, розділені двома та більше простими вуглець-вуглецевими зв'язками:
![]()
10.5.1. Способи добування
Основними способами добування галогеналкенів є:
Гідрогалогенування алкінів (див. с. 62):
![]()
Галогенування алкенів в алільне положення (див. с. 45):
![]()
![]()
Дія галогенуючих реагентів (РСl3, РС15, SОС12) на ненасичені спирти (див. с. 254):
![]()
![]()
10.5.2. Хімічні властивості
Хімічні
властивості галогеналкенів зумовлені
наявністю в їх структурі двох угруповань:
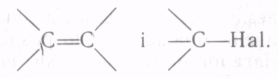 Будучи біфункціональними сполуками,
галогеналкени по подвійному зв'язку
здатні вступати в реакції, характерні
для алкенів (приєднання, полімеризація
та ін., див. с. 33), а по зв'язку вуглець —
галоген — в реакції заміщення та
відщеплення, властиві галогеналканам.
Проте реакційна здатність галогеналкенів
багато в чому залежить від взаємного
розміщення атома галогену та подвійного
зв'язку в молекулі. Якщо в сполуці атом
галогену та подвійний зв'язок досить
віддалені один від одного (розділені
двома та більше простими вуглець-вуглецевими
зв'язками), то кожна з цих груп поводить
себе незалежно від іншої.
Будучи біфункціональними сполуками,
галогеналкени по подвійному зв'язку
здатні вступати в реакції, характерні
для алкенів (приєднання, полімеризація
та ін., див. с. 33), а по зв'язку вуглець —
галоген — в реакції заміщення та
відщеплення, властиві галогеналканам.
Проте реакційна здатність галогеналкенів
багато в чому залежить від взаємного
розміщення атома галогену та подвійного
зв'язку в молекулі. Якщо в сполуці атом
галогену та подвійний зв'язок досить
віддалені один від одного (розділені
двома та більше простими вуглець-вуглецевими
зв'язками), то кожна з цих груп поводить
себе незалежно від іншої.
Разом з тим галогеналкени, що містять атом галогену біля вуглецю, який утворює подвійний зв'язок (вінілгалогеніди), внаслідок взаємного впливу зазначених угруповань характеризуються низькою реакційною здатністю зв'язку С—Наl і подвійного зв'язку. Атом галогену в цих сполуках малорухливий і насилу заміщується на інші атоми та групи. Реакції приєднання за місцем розриву подвійного зв'язку також ідуть важче, ніж, наприклад, в етилені.
Причиною низької реакційної здатності зв'язку С—Наl є спряження неподіленої пари електронів атома галогену з π-електронами подвійного зв'язку (атом галогену виявляє +М-ефект):
![]()
У результаті спряження зв'язок С—Наl вкорочується та стає значно міцнішим, ніж у галогеналканах. Тому реакції нуклеофільного заміщення для вінілгалогенідів у більшості випадків здійснити не удається. При звичайній температурі вони практично не ідуть, а при нагріванні проходять побічні процеси — відщеплення галогеноводню, приєднання за місцем розриву подвійного зв'язку, полімеризація.
У присутності концентрованих розчинів лугів вінілгалогеніди, що містять атом водню біля вуглецю, який утворює подвійний зв'язок, відщеплюють галогеноводень і перетворюються на алкіни:

![]()
Поряд з цим у молекулі вінілгалогеніду атом галогену за рахунок сильного негативного індуктивного ефекту зменшує електронну густину подвійного зв'язку і тим самим знижує його реакційну здатність в реакціях електрофільного приєднання. Тому вінілгалогеніди приєднують галогени, галогеноводні та інші електрофільні реагенти важче, ніж відповідні алкени. Приєднання галогеноводнів проходить за правилом Марковникова:
![]()
У присутності каталізаторів вінілгалогеніди легко вступають в реакції полімеризації, які знаходять широке застосування у виробництві полімерних матеріалів:

На відміну від вінілгалогенідів, у молекулах алілгалогенідів атом галогену виявляє підвищену рухливість. Алілгалогеніди вступають в реакції нуклеофільного заміщення легше, ніж галогеналкани. Заміщення, як правило, відбувається за механізмом SN1.
Висока активність алілгалогенідів у реакціях нуклеофільного заміщення пояснюється їх схильністю до іонізації, оскільки при цьому утворюється досить стійкий алільний катіон:
![]()
Стабільність алільного катіона зумовлена делокалізацією позитивного заряду по спряженій системі:
![]()
Внаслідок електроноакцепторного впливу атома галогену, реакційна здатність подвійного зв'язку в алілгалогенідах дещо нижча, ніж у відповідних алкенах, проте приєднання галогеноводнівіде за правилом Марковникова:

