
- •Ю. Д. Воробьёв физика атома и физика твёрдого тела
- •Оглавление
- •2. Лабораторная работа 3.17 18
- •3. Лабораторная работа № 3.18 21
- •4. Лабораторная работа № 3.19. 23
- •Краткая теория
- •1. Спектр атома водорода
- •2. Постулаты Бора
- •3. Опыт Франка и Герца
- •4. Теория спектра атома водорода по Бору
- •Экспериментальная часть
- •1. Лабораторная работа № 3.49 опыт франка и герца
- •Задание к работе
- •Контрольные вопросы
- •2. Лабораторная работа 3.17 изучение спектра атома водорода
- •Методика измерений.
- •Градуировка монохроматора ум-2.
- •Определение длин волн спектра излучения атома водорода.
- •Контрольные вопросы.
- •3. Лабораторная работа № 3.18 изучение спектра излучения атомов
- •Краткая теория
- •Методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы.
- •4. Лабораторная работа № 3.19. Спектральный анализ
- •Развитие спектрального анализа
- •Постулаты Бора
- •Спектральные приборы
- •Принципиальная схема спектрального прибора и назначение отдельных узлов.
- •Приемно-регистрирующие устройства
- •Описание метода измерений
- •Порядок проведения эксперимента Упражнение 1 Градуировка монохроматора ум-2
- •Упражнение 2. Определение неизвестного элемента по его спектру излучения (качественный спектральный анализ).
- •Упражнение 3.
- •Задания:1
- •Контрольные вопросы
- •5. Лабораторная работа № 3.20м. Моделирование спектра атома водорода
- •Методика эксперимента
- •Задание 1.
- •Задание №2.
- •Контрольные вопросы
- •Приложение № 3 Монохроматор ум-2
- •1. Электропроволность твердых тел
- •1.1. Зонная структура твёрдых тел
- •1.2. Электропроводность
- •1.3. Концентрация носителей тока
- •1.3.1. Металлы
- •1.3.2. Равновесные носители тока в полупроводнике
- •1.3.3. Неравновесные носители тока в полупроводнике
- •1.4. Движение носителей тока
- •2. Контакт двух металлов по зонной теории
- •2.1. Термоэлектрические явления и их применение
- •1. Лабораторная работа № 3. 10м термометретия
- •Методика эксперимента
- •1. Термометрические параметры
- •2. Температурные шкалы
- •3. Виды термометров
- •3.3. Твердотельные термометры.
- •1.3.4. Оптическая термометрия
- •2. Практическая часть
- •2.2 Градуировка термометра сопротивления.
- •Правила пользования прибором.
- •2.2 Градуировка термистора.
- •2.3. Градуировка термопары
- •Методика эксперимента
- •Экспериментальная установка
- •Порядок выполнения работы
- •Обработка результатов
- •Задание 1
- •Контрольные вопросы
- •3. Лабораторная работа № 3.03 фотопроводимрсть полупроводников
- •Методика эксперимента
- •Экспериментальная установка
- •Проведение эксперимента
- •Обработка результатов
- •Контрольные вопросы
- •4. Лабораторная работа № 3. 11 изучение температурной зависимости электросопротивления полупроводника
- •Методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •5. Лабораторная работа № 3.12 изучение спектральной характеристики фоторезистора
- •Краткая теория и методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы.
- •6. Лабораторная работа № 46 а термоэлектронная эмиссия контактная разность потенциалов
- •Краткое теоретическое введение
- •Теория метода задерживающего потенциала
- •Методика измерений
- •7. Лабораторная работа № 3.47 распределение электронов по скоростям при термоэлектронной эмиссии
- •Введение
- •Методика измерений
- •Приложение 1 Модульный учебный комплекс мук-ок «квантовая оптика»
- •Приложение к лаб. Работам № 46а, 47
- •690059, Владивосток, ул. Верхнепортовая, 50а
Определение длин волн спектра излучения атома водорода.
2.1. В качестве источника света установите водородную лампу, включите её (в присутствии преподавателя или лаборанта), сфокусируйте её изображение на входную щель монохроматора, добейтесь чёткого изображения спектральных линий. При слабом свечении лампы ширину входной щели 3 можно увеличить по сравнению с предыдущим опытом.
2.2. Снимите отсчёты по барабану монохроматора для не менее чем трёх наиболее ярких линий спектра излучения водорода и занесите данные в табл. 3.
Таблица 3
Длины волн спектра излучения атомов водорода
-
Цвет
линии
Показания
барабана , град.
, нм
Красная
3
Голубая
4
Синяя
5
2.3. По градуированному графику определите длины волн серии.
2.4.
Из формулы Бальмера (1.1) найдите
экспериментальные значения постоянной
Ридберга
для каждой длины волны. Рассчитайте
среднее значении
![]() и
определите погрешность
и
определите погрешность
![]() .'
.'
2.5. По формуле (4.6) рассчитайте теоретическое значение R. Сравните полученный результат с табличным значением.
2.6. По формуле (4.4) определите теоретическое значение потенциала ионизации атома водорода.
Контрольные вопросы.
1. Нарисуйте оптическую схему и опишите принцип действия спектрального прибора.
2. Как формулируются постулаты Бора для атома водорода?
3. Какие спектральные серии излучаются атомом водорода?
4. Какие линии излучения атома водорода находятся в видимой области спектра? Какие переходы электрона в атоме происходят при излучении этих линий?
3. Лабораторная работа № 3.18 изучение спектра излучения атомов
Цель работы: Наблюдение спектральных линий излучения атомов неона и ртути.
Приборы и принадлежности: Монохроматор УМ-2, неоновая лампа, ртутная лампа.
Краткая теория
По теории Бора энергия электронов в атоме может принимать не любые, а только некоторые определённые значения, образующие дискретный набор. Состояния с таким набором энергии называются уровнями. Спектральные линии возникают при переходе электронов с одного уровня, на другой (более низкий). При этом энергия излучаемого фотона равна разности этих двух уровней:
![]() (1)
(1)
где
![]()
![]() - постоянная Планка, равная 6,625-10 34 Дж-с,
- постоянная Планка, равная 6,625-10 34 Дж-с,
![]() - частота излучения,
- частота излучения,
![]() и
и
![]() - энергии электрона в атоме. Соотношение
(1) может быть представлено в виде:
- энергии электрона в атоме. Соотношение
(1) может быть представлено в виде:
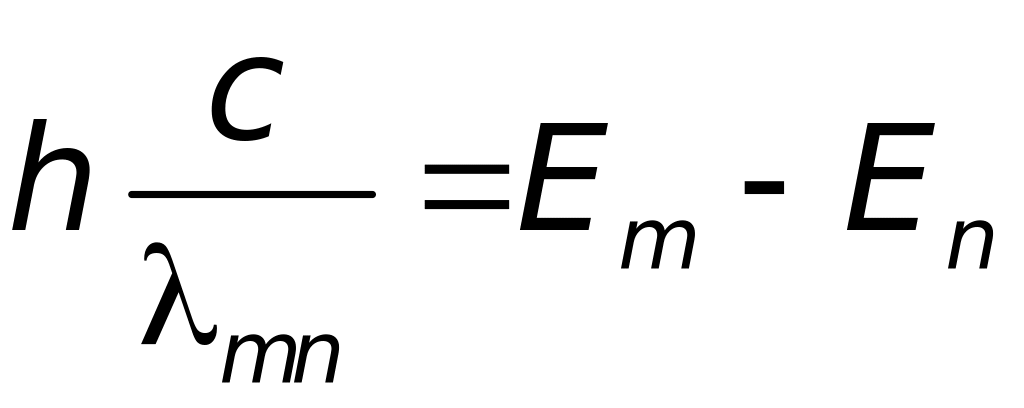 (2)
(2)
где
![]() - длина волны излучения атома.
- длина волны излучения атома.
При наличии диспергирующей среды (призма) в зависимости от длины волны мы можем наблюдать набор спектральных линий, характерный для данного вида атома. На этом основан качественный спектральный анализ, позволяющий обнаруживать атомы в излучающей среде. Для каждого атома набор спектральных линий отличается количеством и расположением в оптическом диапазоне шкалы электромагнитных волн. В приложении 1 показаны спектры атомов некоторых элементов.
В данной работе изучаются спектральные линии неона и ртути визуальным способом.
