
- •Ю. Д. Воробьёв физика атома и физика твёрдого тела
- •Оглавление
- •2. Лабораторная работа 3.17 18
- •3. Лабораторная работа № 3.18 21
- •4. Лабораторная работа № 3.19. 23
- •Краткая теория
- •1. Спектр атома водорода
- •2. Постулаты Бора
- •3. Опыт Франка и Герца
- •4. Теория спектра атома водорода по Бору
- •Экспериментальная часть
- •1. Лабораторная работа № 3.49 опыт франка и герца
- •Задание к работе
- •Контрольные вопросы
- •2. Лабораторная работа 3.17 изучение спектра атома водорода
- •Методика измерений.
- •Градуировка монохроматора ум-2.
- •Определение длин волн спектра излучения атома водорода.
- •Контрольные вопросы.
- •3. Лабораторная работа № 3.18 изучение спектра излучения атомов
- •Краткая теория
- •Методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы.
- •4. Лабораторная работа № 3.19. Спектральный анализ
- •Развитие спектрального анализа
- •Постулаты Бора
- •Спектральные приборы
- •Принципиальная схема спектрального прибора и назначение отдельных узлов.
- •Приемно-регистрирующие устройства
- •Описание метода измерений
- •Порядок проведения эксперимента Упражнение 1 Градуировка монохроматора ум-2
- •Упражнение 2. Определение неизвестного элемента по его спектру излучения (качественный спектральный анализ).
- •Упражнение 3.
- •Задания:1
- •Контрольные вопросы
- •5. Лабораторная работа № 3.20м. Моделирование спектра атома водорода
- •Методика эксперимента
- •Задание 1.
- •Задание №2.
- •Контрольные вопросы
- •Приложение № 3 Монохроматор ум-2
- •1. Электропроволность твердых тел
- •1.1. Зонная структура твёрдых тел
- •1.2. Электропроводность
- •1.3. Концентрация носителей тока
- •1.3.1. Металлы
- •1.3.2. Равновесные носители тока в полупроводнике
- •1.3.3. Неравновесные носители тока в полупроводнике
- •1.4. Движение носителей тока
- •2. Контакт двух металлов по зонной теории
- •2.1. Термоэлектрические явления и их применение
- •1. Лабораторная работа № 3. 10м термометретия
- •Методика эксперимента
- •1. Термометрические параметры
- •2. Температурные шкалы
- •3. Виды термометров
- •3.3. Твердотельные термометры.
- •1.3.4. Оптическая термометрия
- •2. Практическая часть
- •2.2 Градуировка термометра сопротивления.
- •Правила пользования прибором.
- •2.2 Градуировка термистора.
- •2.3. Градуировка термопары
- •Методика эксперимента
- •Экспериментальная установка
- •Порядок выполнения работы
- •Обработка результатов
- •Задание 1
- •Контрольные вопросы
- •3. Лабораторная работа № 3.03 фотопроводимрсть полупроводников
- •Методика эксперимента
- •Экспериментальная установка
- •Проведение эксперимента
- •Обработка результатов
- •Контрольные вопросы
- •4. Лабораторная работа № 3. 11 изучение температурной зависимости электросопротивления полупроводника
- •Методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •5. Лабораторная работа № 3.12 изучение спектральной характеристики фоторезистора
- •Краткая теория и методика измерений
- •Порядок выполнения работы
- •Контрольные вопросы.
- •6. Лабораторная работа № 46 а термоэлектронная эмиссия контактная разность потенциалов
- •Краткое теоретическое введение
- •Теория метода задерживающего потенциала
- •Методика измерений
- •7. Лабораторная работа № 3.47 распределение электронов по скоростям при термоэлектронной эмиссии
- •Введение
- •Методика измерений
- •Приложение 1 Модульный учебный комплекс мук-ок «квантовая оптика»
- •Приложение к лаб. Работам № 46а, 47
- •690059, Владивосток, ул. Верхнепортовая, 50а
4. Теория спектра атома водорода по Бору
В
1913 году
Бор, используя резерфордовскую модель
атома, гипотезу Планка и предложенные
им постулаты, разработал теорию спектра
водородоподобного атома – атома
содержащего ядро с зарядом
![]() и один электрон, который движется вокруг
ядра (например, ионы
и один электрон, который движется вокруг
ядра (например, ионы
![]() и
и
![]() ).
Если
).
Если
![]() такая система соответствует атому
водорода.
такая система соответствует атому
водорода.
При
рассмотрение движения электрона в
водородоподобной системе, ограничимся
круговыми стационарными орбитами.
Согласно
первому постулату Бора возможны только
такие орбиты, для которых момент импульса
электрона на этой орбите
![]() удовлетворяет условию:
удовлетворяет условию:
![]() (
= 1, 2, 3, ). (4.1)
(
= 1, 2, 3, ). (4.1)
Уравнение движения электрона (второй закон Ньютона) имеет вид:
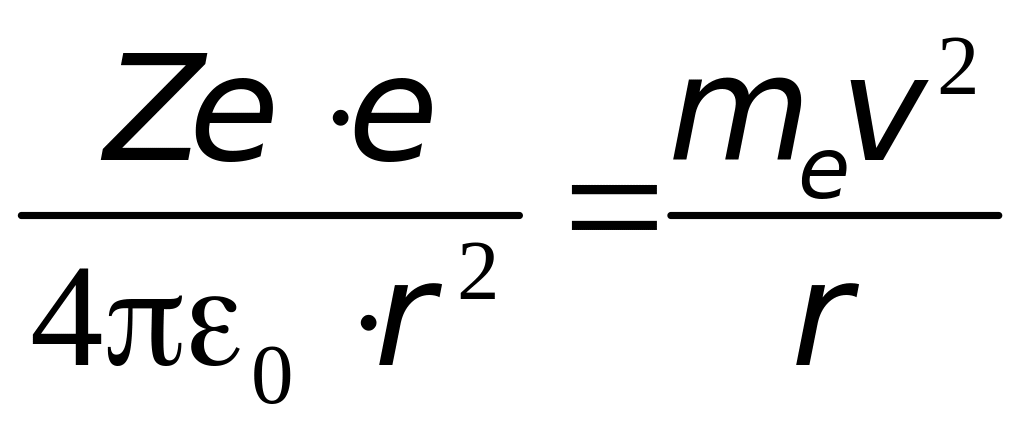 (4.2)
(4.2)
Выразив из (4.1) линейную скорость электрона и подставив в (4.2) получим выражение для радиусов разрешённых орбит:
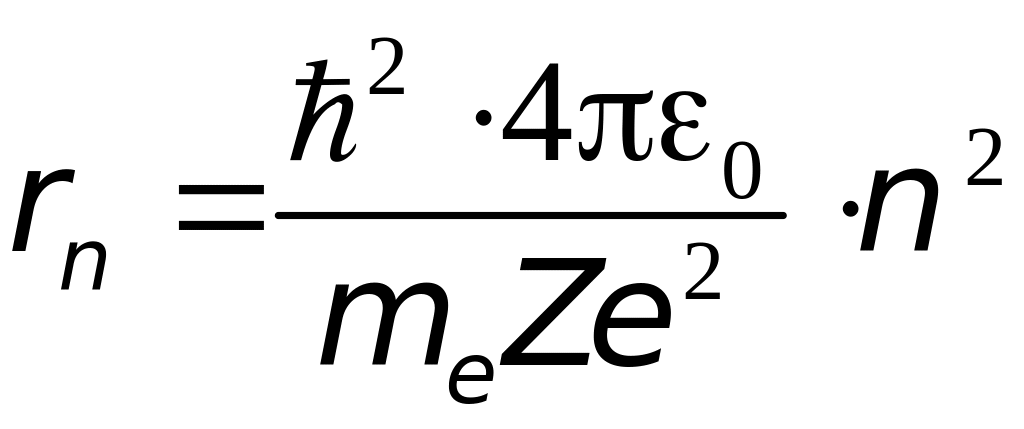 (
= 1, 2, 3, ). (4.3)
(
= 1, 2, 3, ). (4.3)
Радиус
первой орбиты водородоподобного атома
при
![]() называется первым боровским радиусом:
называется первым боровским радиусом:
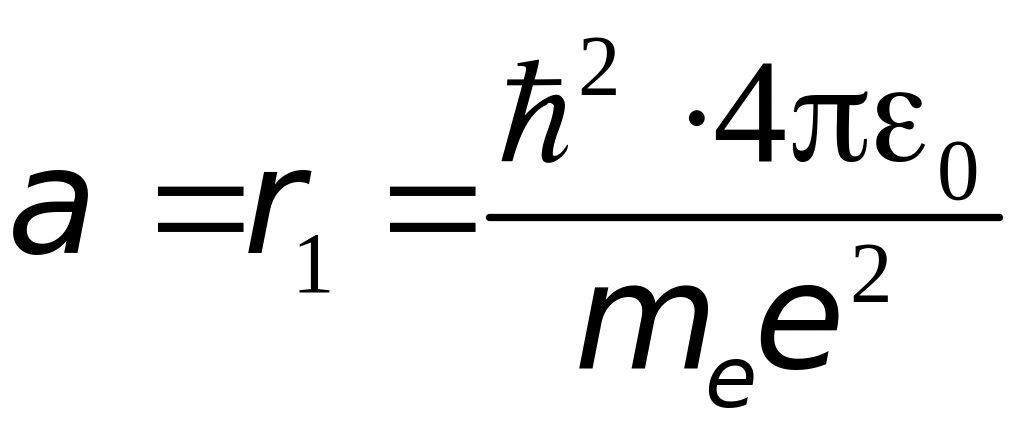 =
5,28∙10-11
м = 0.529Å.
=
5,28∙10-11
м = 0.529Å.
Отметим,
что боровский радиус
![]() совпадает со значением газокинетических
размеров атомов. Так как радиусы
стационарных орбит измерить невозможно,
необходимо вывести из теории такие
величины которые поддаются экспериментальному
определению. Такой величиной является
энергия, излучаемая или поглощаемая
атомами водорода.
совпадает со значением газокинетических
размеров атомов. Так как радиусы
стационарных орбит измерить невозможно,
необходимо вывести из теории такие
величины которые поддаются экспериментальному
определению. Такой величиной является
энергия, излучаемая или поглощаемая
атомами водорода.
Внутренняя энергия атома слагается из кинетической энергии электрона (считаем ядро неподвижным) и энергии взаимодействия электрона с ядром
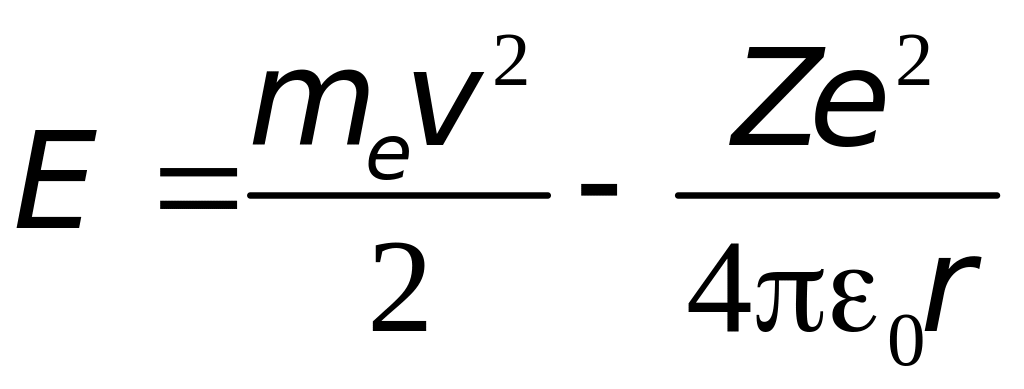 .
.
Из (4.2) следует
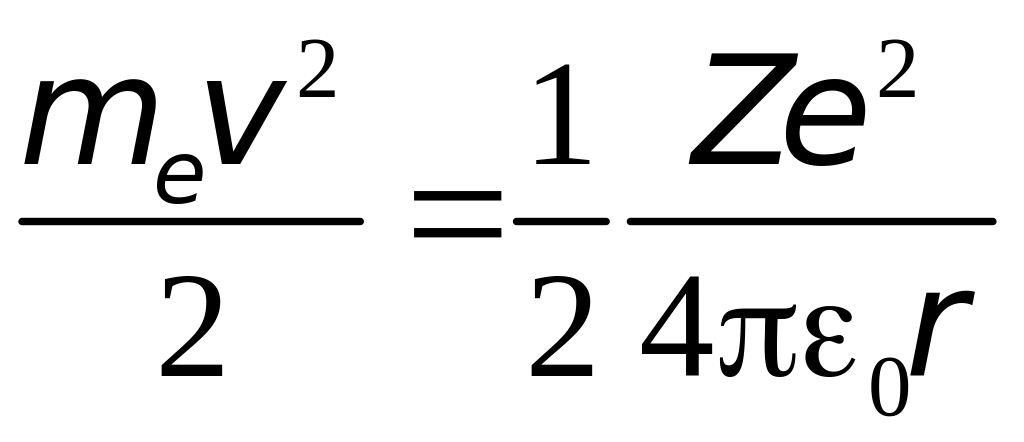 .
.
Следовательно
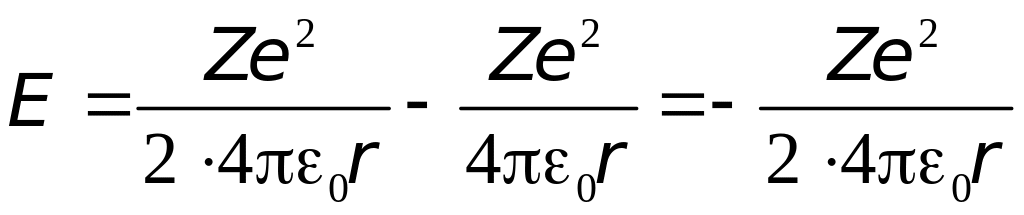
Подставив сюда выражение для радиуса стационарных орбит (4.3) найдём разрешённые значения внутренней энергии атома:
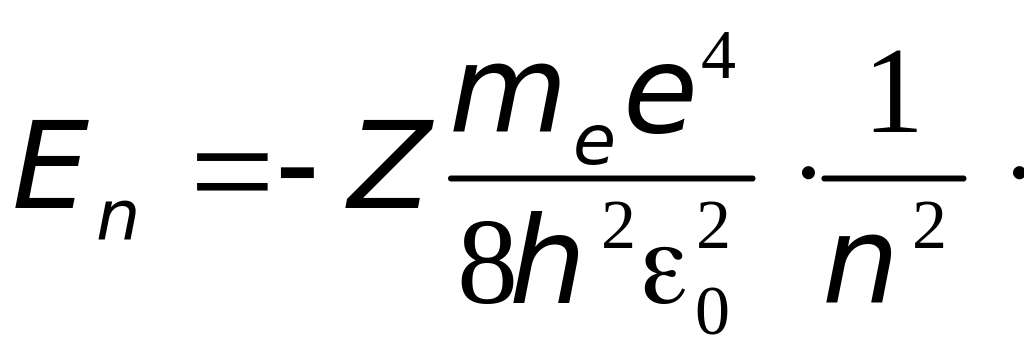 (
= 1, 2, 3,….∞) (4.4)
(
= 1, 2, 3,….∞) (4.4)
где знак минус означает, что электрон находится в связанном состоянии.
Схема энергетических уровней определяемой формулой (4.4) приведена на рис.7.
Целое число , определяющее энергетические уровни атома, называется главным квантовым числом. Энергетический уровень с = 1 называется основным (нормальным) уровнем, а соответствующее ему состояние атома называется основным (нормальным) состоянием. Уровни с >1 и соответствующие им состояния называются возбуждёнными. Придавая целочисленные значения, получаем для атома водорода энергетические уровни, или линейчатый спектр, представленный на рисунке. Минимальная энергия атома водорода: Е1 = -13,55 эВ.
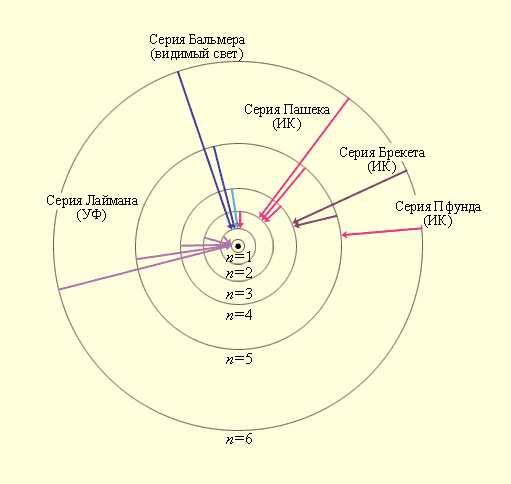
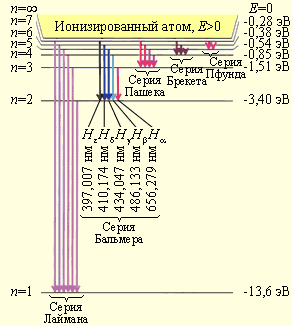
Рис. 7
Максимальная
энергия электрона E∞
= 0 при
= ∞ называется
энергией
ионизации
атома (при Е
= E∞
происходит отрыв электрона от атома),
то есть
![]() или
или
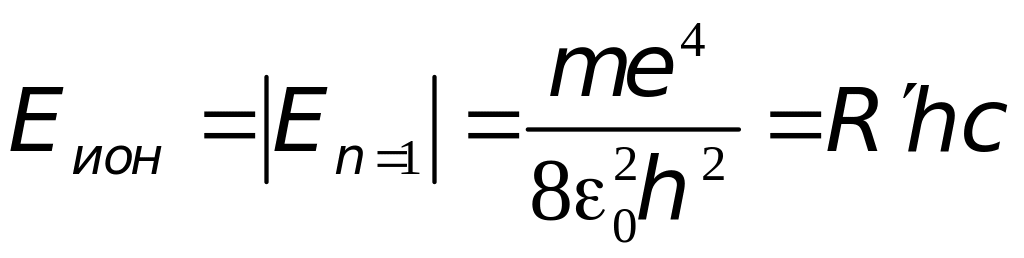
Переход из стационарного состояния в стационарное состояние , согласно второму постулату Бора, сопровождается испусканием кванта света:
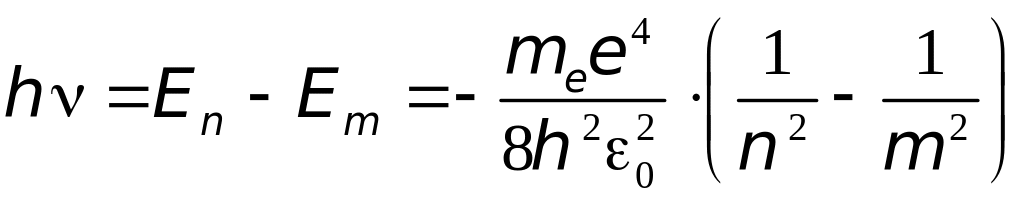 .
.
Отсюда частота излучённого кванта
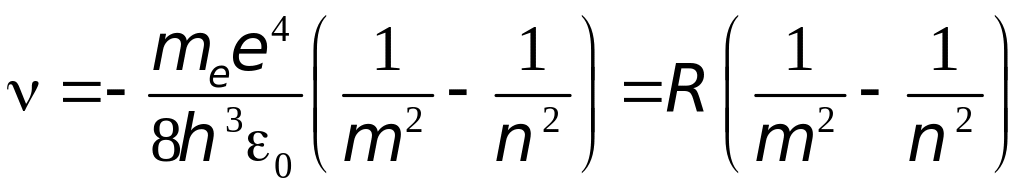 (4.5)
(4.5)
где
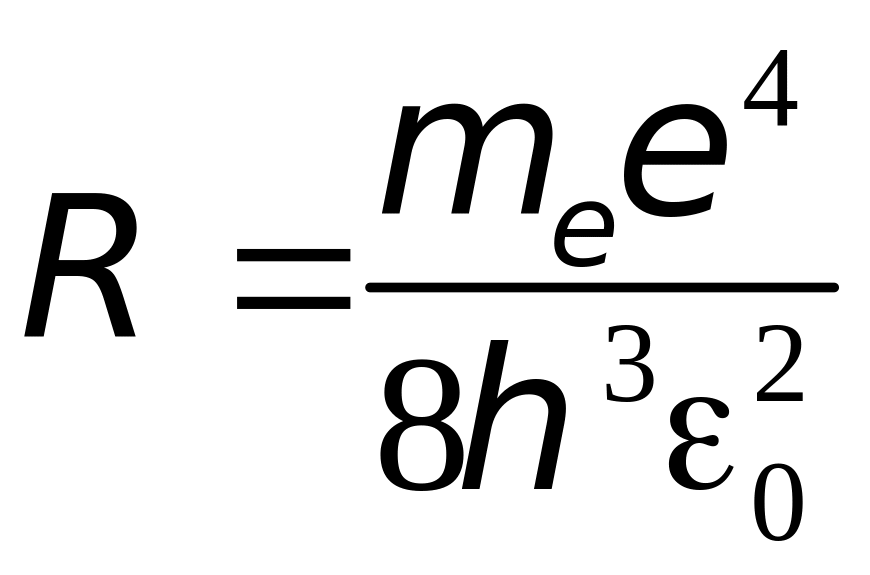 (4.6)
(4.6)
- теоретическое формула постоянной Ридберга.
Мы
пришли к обобщённой формуле Бальмера.
Теоретическое значение
![]() хорошо согласуется со значением
постоянной Ридберга, определенным
экспериментально.
хорошо согласуется со значением
постоянной Ридберга, определенным
экспериментально.
Теория Бора сыграла огромную роль в создании атомной физики, в развитии атомной и молекулярной спектроскопии, но её внутренняя противоречивость — соединение классических и квантовых представлений — не позволили на её основе объяснить спектры многоэлектронных атомов (даже простейшего из них — атома гелия, содержащего помимо ядра два электрона).
