
Харьковская медицинская академия последипломного образования ХМАПО
Медицинский колледж
РЕФЕРАТ
по химии
на тему: «Основные классы неорганических соединений: их свойства, получение номенклатур»
Выполнила:
студентка 2-го курса
группы М-12
Заморева Дарья
Харьков 2013
Классификация простых и сложных веществ.
Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ. Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ. Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли. Приведенная первичная классификация является несовершенной. Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, соединений неметаллов с другими неметаллами и т.д.
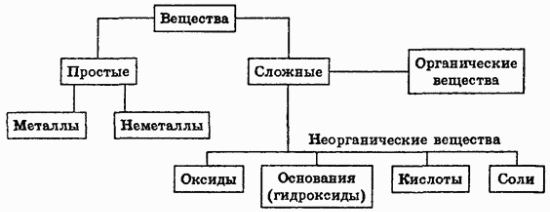
Вот схема, отражающую генетическую связь типичных классов соединений:
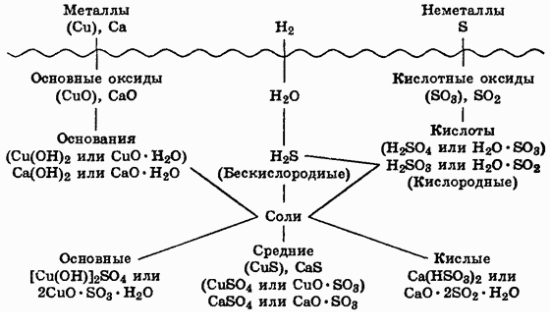
В верхней части схемы помещены две группы простых веществ — металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа — гелия — ему недостает также одного электрона, что роднит его с галогенами.
Волнистая черта отделяет простые
вещества от сложных; она символизирует,
что пересечение этой границы, т.е. любая
реакция простых веществ со сложными,
будет обязательно затрагивать валентные
оболочки атомов в простых веществах,
следовательно, любая реакция с участием
простых веществ будет
окислительно-восстановительной. В левой
части схемы под металлами помещены их
типичные соединения — основные оксиды
и основания, в правой части схемы помещены
соединения, типичные для неметаллов, —
кислотные оксиды и кислоты. Водород,
помещенный в верхней части схемы, дает
очень специфический, идеально амфотерный
оксид — воду
![]() ,
которая в комбинации с основным оксидом
дает основание, а с кислотным — кислоту.
Водород в сочетании с неметаллами
образует бескислородные кислоты. В
нижней части схемы помещены соли,
которые, с одной стороны, отвечают
соединению металла с неметаллом, а с
другой — комбинации основного оксида
с кислотным.
,
которая в комбинации с основным оксидом
дает основание, а с кислотным — кислоту.
Водород в сочетании с неметаллами
образует бескислородные кислоты. В
нижней части схемы помещены соли,
которые, с одной стороны, отвечают
соединению металла с неметаллом, а с
другой — комбинации основного оксида
с кислотным.
Приведенная схема до некоторой степени
отражает и возможности протекания
химических реакций — как правило, в
химическое взаимодействие вступают
соединения, принадлежащие к разным
половинам схемы. Так, основные оксиды
реагируют с кислотными оксидами,
кислотами и кислыми солями; кислоты
реагируют с металлами, основными
оксидами, основаниями, основными и
средними солями. Естественно, что такая
схема не дает исчерпывающей информации
обо всех возможных реакциях, однако она
отражает основные типы реакций. Заметим,
что при составлении схемы использован
один старый, но очень полезный прием:
формулы оснований, кислот и солей
представлены на ней как комбинации
оксидов. Этот прием широко применяется,
например, в геологии для описания
минералов. Так, формула талька
![]() наглядно
представляется другой формулой —
наглядно
представляется другой формулой —
![]() формула
изумруда
формула
изумруда
![]() может
быть записана как
может
быть записана как
![]()
Далее рассмотрим подробнее отдельные классы неорганических соединений:
1.
Оксиды
– это бинарные химические соединения,
содержащие атомы кислорода в степени
окисления –2, между которыми отсутствует
ковалентная связь. Например, не являются
оксидами пероксид натрия
![]() и
фторид кислорода
и
фторид кислорода![]() .
.
Классификация:
1.По типу химической связи:
Ионные (оксиды металлов):
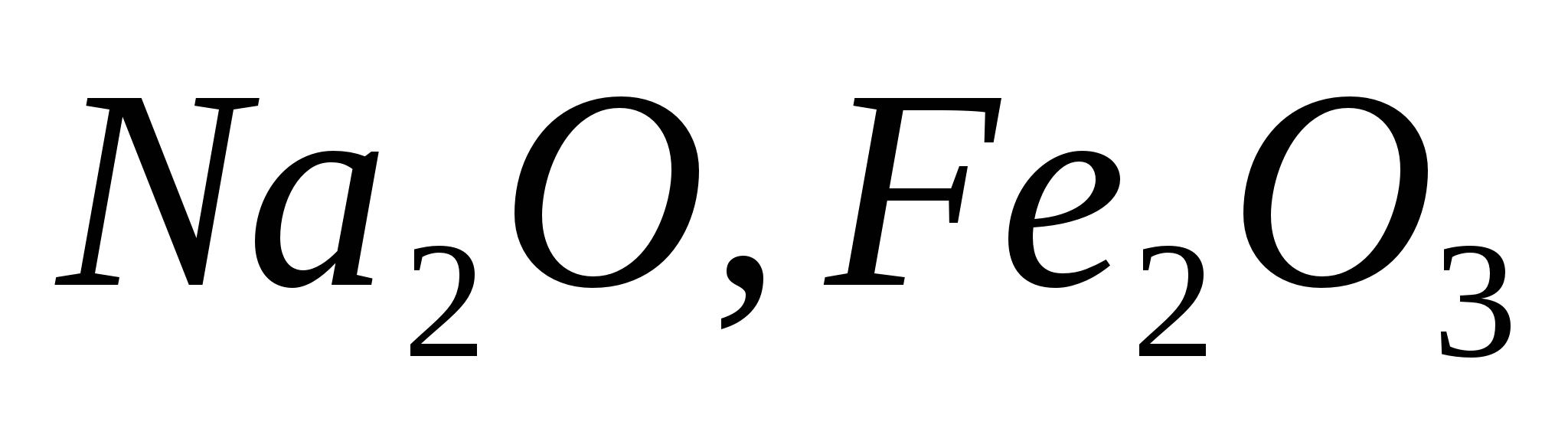 ;
;Ковалентные (оксиды неметаллов):
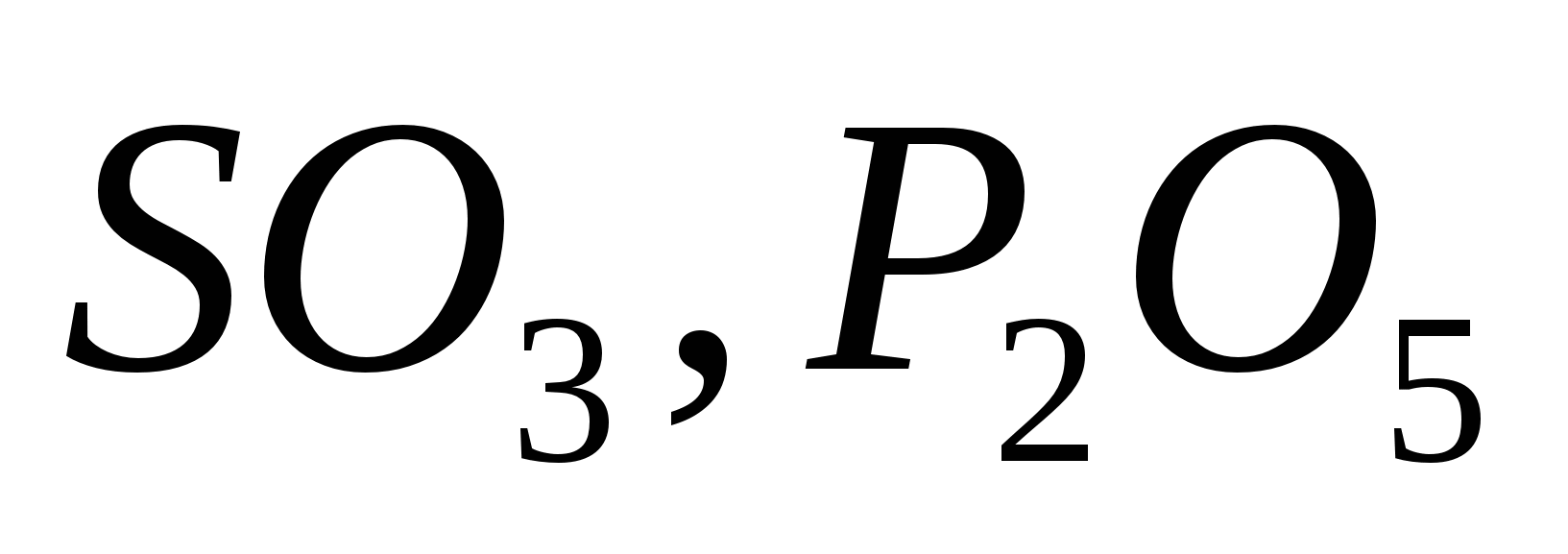 .
.
2. По химическим свойствам:
Основные (оксиды, которым соответствуют основания; валентность элемента, образующего оксид < 4):
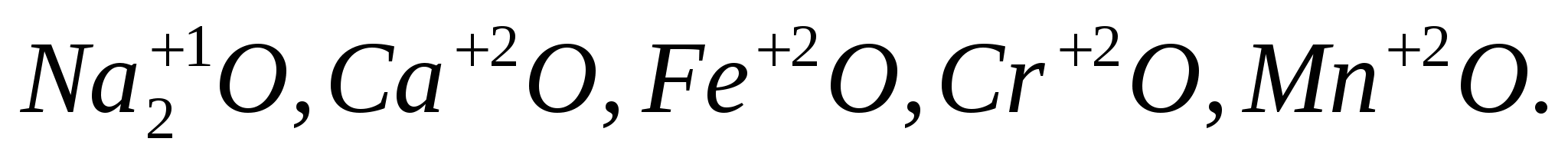 :
:Кислотные (оксиды, которым соответствуют кислоты; валентность элемента, образующего оксид ≥ 4):
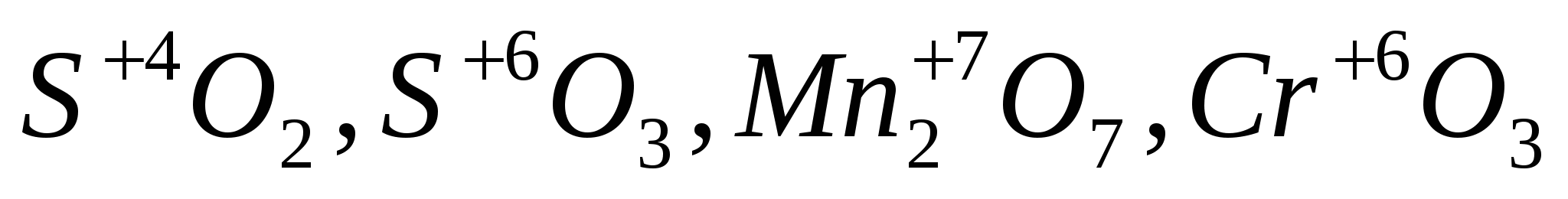 :
:
Амфотерные (оксиды, проявляющие свойства кислотных и основных оксидов). В состав амфотерного оксида входит элемент – амфоген или переходный элемент:
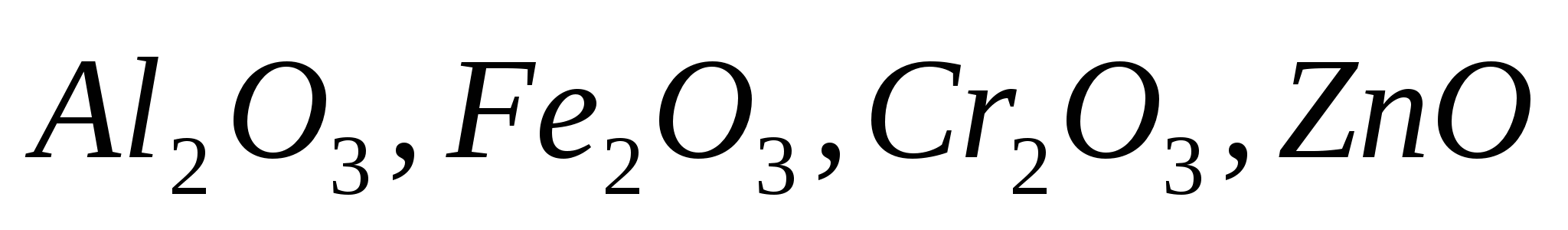 :
:Несолеобразующие или индифферентные (оксиды, которым не соответствуют гидроксиды):
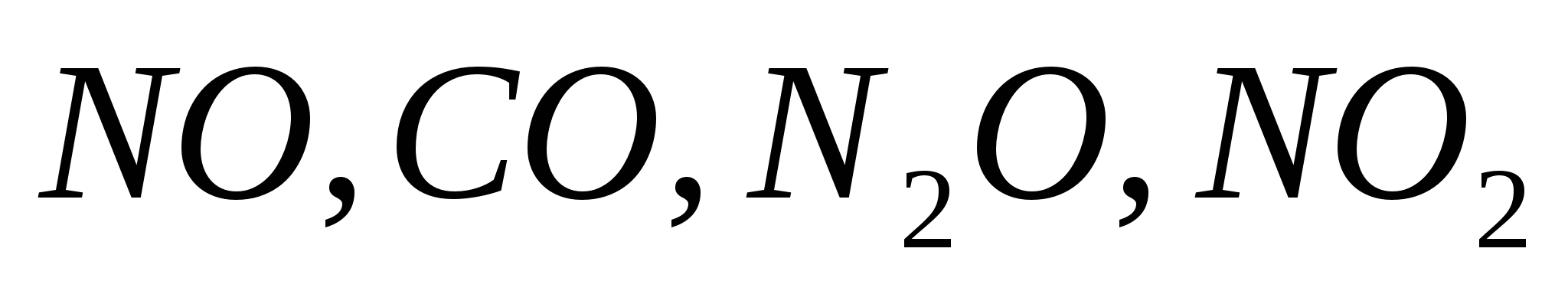 .
.
По отношению к воде:
Взаимодействующие с водой с образованием соответствующего растворимого гидроксида -
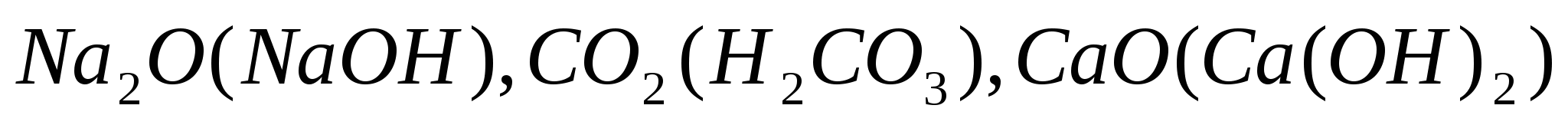 :
:Нерастворимые в воде -
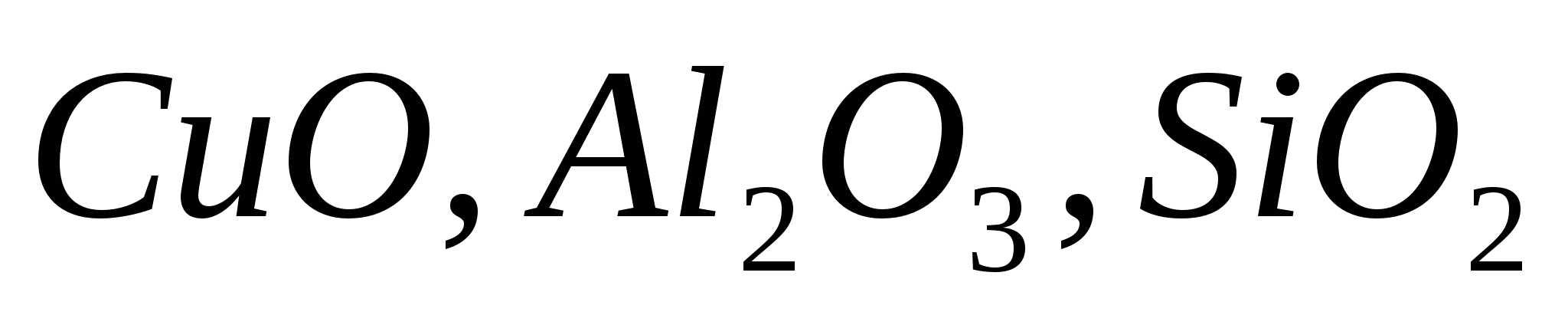 .
.
Способы получения:
Окисление простых веществ:

Окисление сложных веществ:
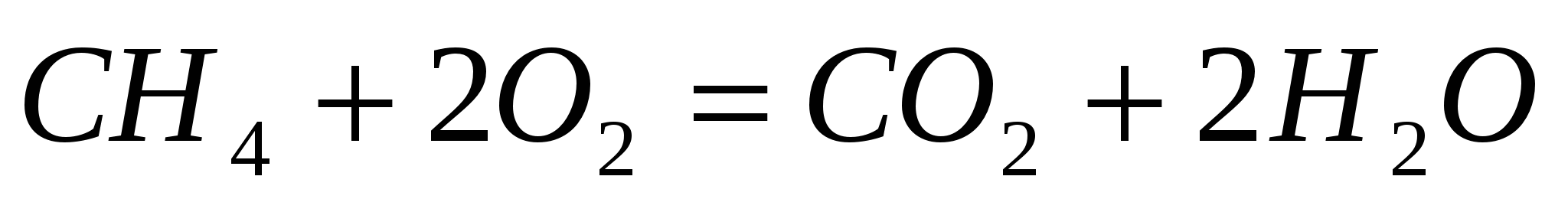
Разложение гидроксидов (нерастворимых или нестабильных):
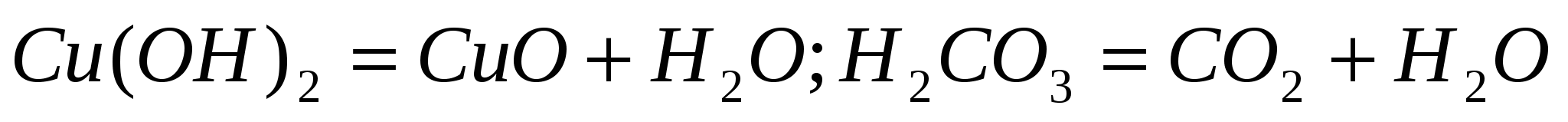
Разложение солей:

Номенклатура:
Согласно международной номенклатуре названия оксидов составляют из латинского корня названия элемента имеющего большую относительную электроотрицательность с окончанием –ид и русского названия элемента с меньшей относительной электроотрицательностью. Если же элемент образует несколько оксидов, то в их названиях указывается валентность элемента римской цифрой в скобках после названия:
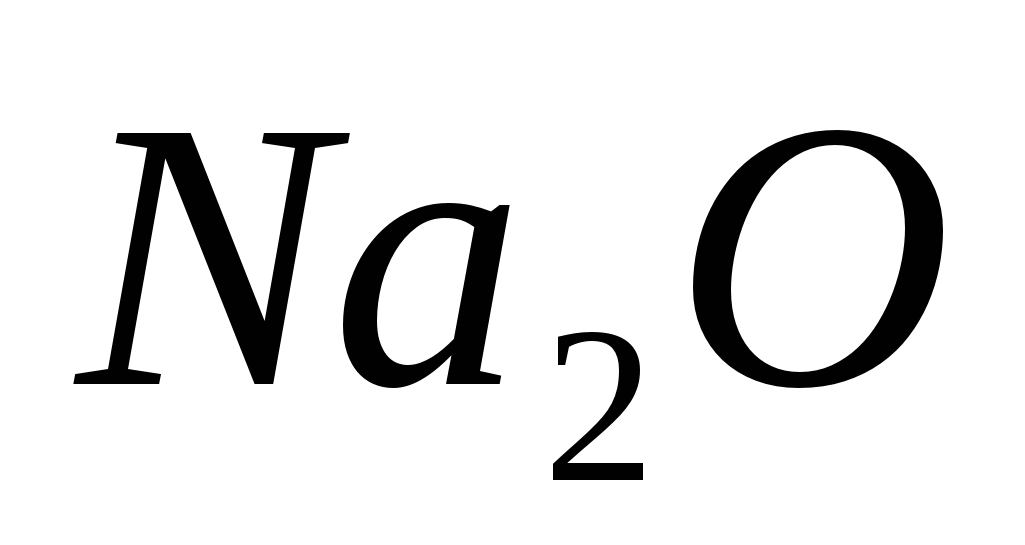 - оксид натрия
- оксид натрия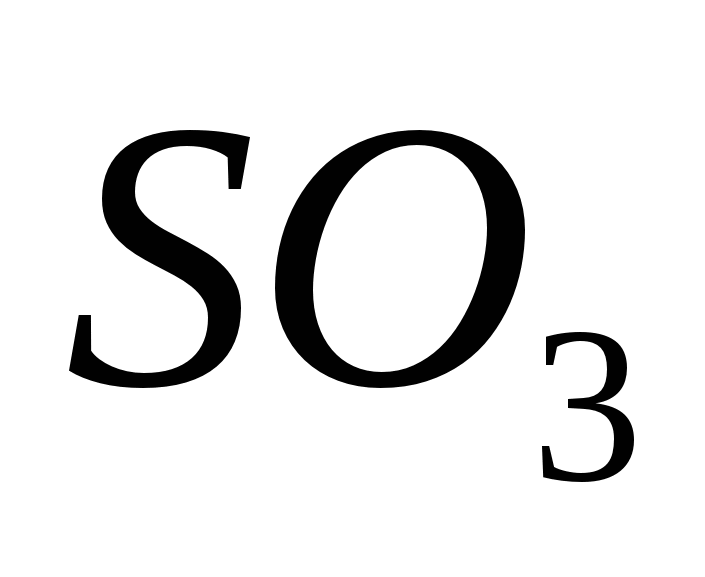 -
оксид серы(VI)
-
оксид серы(VI) -
оксид серы (IV)
-
оксид серы (IV) -
оксид железа (II)
-
оксид железа (II)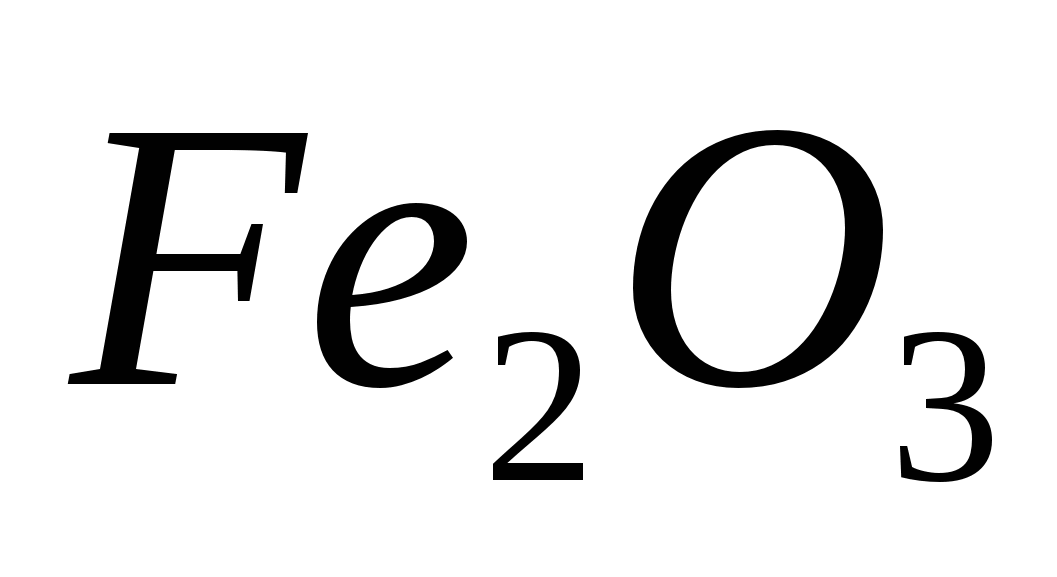 -
оксид железа (III)
-
оксид железа (III)
Химические свойства
Взаимодействие с водой:
Основные оксиды образуют щелочи:
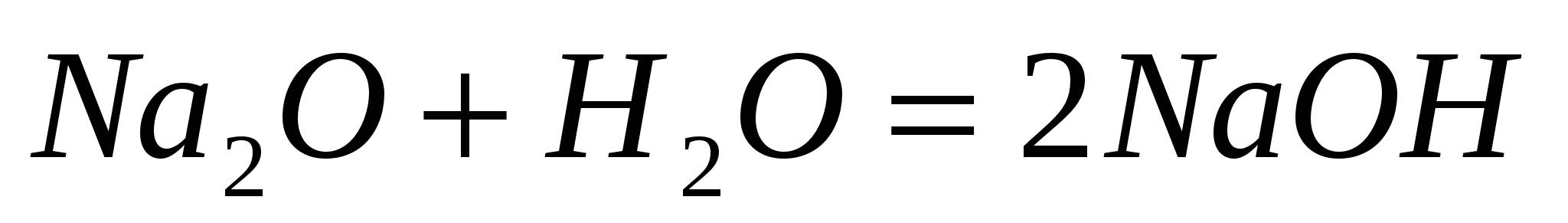 ,
но
,
но
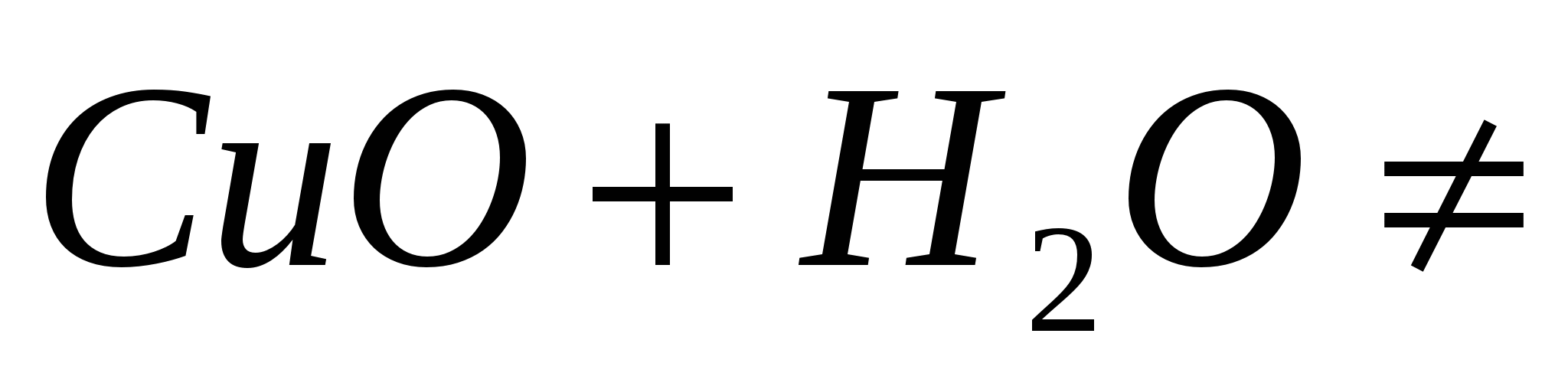 :
:Кислотные оксиды образуют растворимые кислоты:
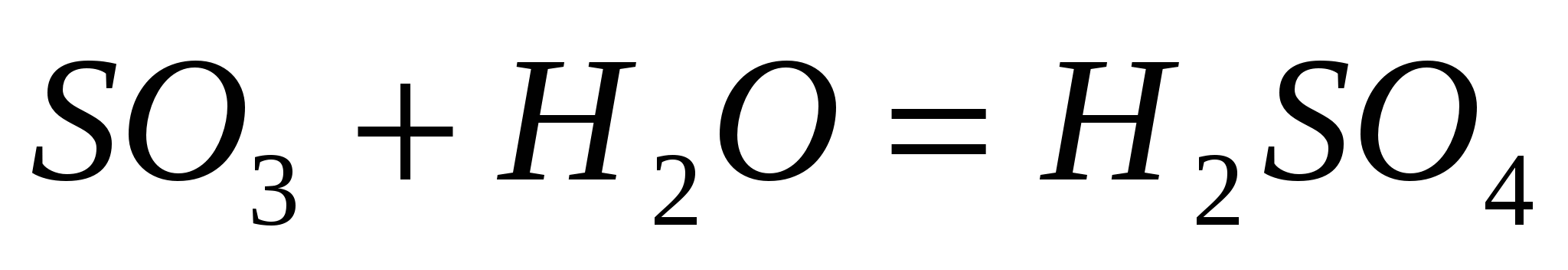 ,
но
,
но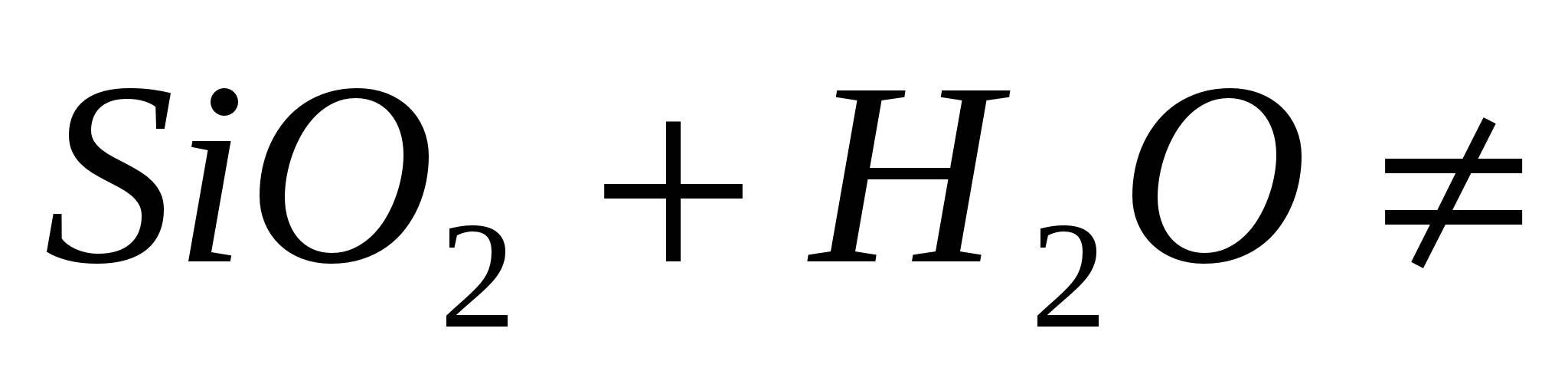 .
.
Взаимодействие основных и амфотерных оксидов с кислотами:
![]()
![]()
Взаимодействие кислотных и амфотерных оксидов со щелочами:
![]()
![]()
Взаимодействие кислотных и основных оксидов:
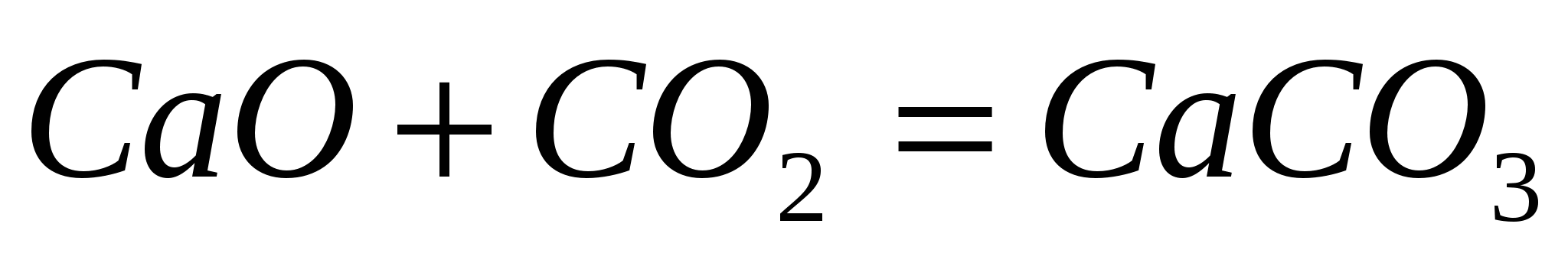
Восстановление оксидов:
![]()
![]()
![]()
Вытеснение оксида из соли оксидом более сильной кислоты:
![]()
2. Основания (гидроксиды металлов)
Основания - это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп. По современной номенклатуре их принято называть гидроксидами элементов с указанием степени окисления: — гидроксид калия, КОИ — гидроксид натрия, — гидроксид кальция, — гидроксид хрома (II), — гидроксид хрома (III).
Свойствами оснований, однако, могут обладать не только гидроксиды — см. ниже в разделе «Кислоты».
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов ОН- в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее, небольшие равновесные концентрации иона ОН- даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
Получение оснований:
Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
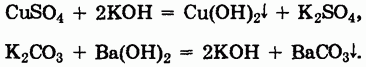
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
Щелочи в технике обычно получают электролизом водных растворов хлоридов:
![]()
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
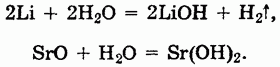
Химические свойства оснований.
Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
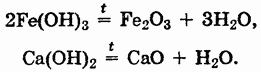
Наиболее характерной реакцией оснований является их взаимодействие с кислотами — реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
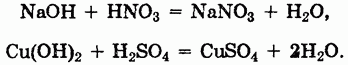
Выше было показано, как щелочи взаимодействуют с кислотными оксидами.
Необходимо особенно подчеркнуть способность растворов щелочей реагировать с некоторыми неметаллами (галогенами, белым фосфором, кремнием):
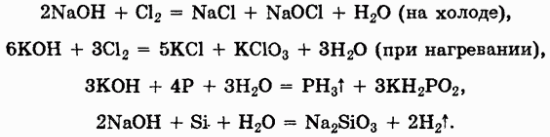
3. Кислоты
Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием — вещество, способное принимать протоны. Любая реакция отщепления протона выражается уравнением
![]()
На базе таких представлений понятными становятся основные свойства аммиака, который за счет неподеленной пары электронов атома азота эффективно принимает протон при взаимодействии с кислотами, образуя за счет донорно-акцепторной связи (см. § 3) ион аммония:
![]()
кислота основание кислота основание
Возможно и еще более общее определение кислот и оснований. Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия — кислота, способная принимать электронную пару при взаимодействии с аммиаком:
![]()
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В только что рассмотренном примере аммиак является основанием.
Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями. В табл. 8.1 сопоставлены различные определения кислот и оснований, используемые в настоящее время при решении физико-химических задач.
Сопоставление определений кислот и оснований

