
- •Для студентів усіх спеціальностей
- •До розв’язування задач за темою “Розчини”
- •0903 “Гірництво”, 0707 “Геологія”, 0925 “Автоматизація та комп’ютерно-інтегровані технології”, 0708 “Екологія”, 0922 “Електромеханіки”, 0906 “Електротехніка”, 0902 “Інженерна механіка”
- •Студенти повинні знати:
- •Необхідно також вміти:
- •Приготування розчинів Для розв’язування задач даного розділу необхідно знати:
- •Приготування розчинів
- •40 Г цукру міститься в 320 г розчину
- •1 Моль містить 85 г.
- •0,2 Моль містить
- •192 Г міститься в 1600 г розчину
- •4,5 Г NaCl знаходяться в 100 г розчину;
- •115,2 Г NaCl знаходяться в .
- •Перерахунок концентрацій
- •1. Визначення молярної і нормальної концентрацій за відомою процентною концентрацією розчину
- •2. Визначення моляльної концентрації за відомою процентною концентрацією розчину
- •3. Розрахування титру розчину за його відомою процентною концентрацією
- •Задачі для самостійного розв’язування
- •Властивості розчинів неелектролітів Осмос і осмотичний тиск
- •12,66 Г гематину знаходиться в 200 мл розчину
- •Підвищення температури кипіння та зниження температури замерзання розчинів
- •Використання законів Вант-Гоффа та Рауля до розчинів електролітів
- •Задачі для самостійного розв’язування
- •Редакційно-видавничий комплекс
- •49027, Дніпропетровськ-27, просп. К.Маркса, 19
4,5 Г NaCl знаходяться в 100 г розчину;
115,2 Г NaCl знаходяться в .
![]() г.
г.
Об’єм одержуваного розчину знаходимо за співвідношенням
![]() мл.
мл.
Початковий розчин потрібно розбавити дистильованою водою до об’єму 2488 мл.
Приклад 6. Скільки мілілітрів 2 н. розчину сірчаної кислоти потрібно для приготування 500 мл 0,5 н. розчину?
Розв’язування. При розбавленні розчину кількість розчиненої речовини, вираженої в будь-яких одиницях (грамах, моль, еквівалентах), залишається постійною. В даному випадку мова йде про кількість еквівалентів, тобто даються нормальні концентрації первинного і одержаного розчинів. Кількість еквівалентів дорівнює добутку нормальної концентрації на об’єм розчину (в літрах):
![]() ;
;
![]() .
.
Отже
![]() .
.
Підставимо у це співвідношення всі задані умовами задачі величини:
![]()
![]() л.
л.
Перерахунок концентрацій
1. Визначення молярної і нормальної концентрацій за відомою процентною концентрацією розчину
Процентна концентрація розчину показує вміст розчиненої речовини в 100 г розчину, а молярна і нормальна – в 1 л розчину.
Необхідно вирахувати:
масу розчиненої речовини в 1 л розчину
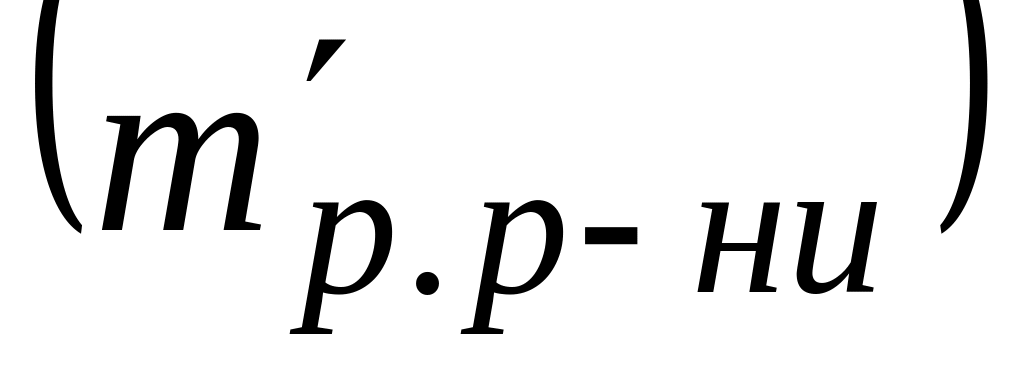 ;
;масу розчину (
 );
);кількість моль розчиненої речовини
 або кількість його еквівалентів
або кількість його еквівалентів
 в 1 л розчину, що відповідає
в 1 л розчину, що відповідає
 і
і
 розчину.
розчину.
У загальному вигляді
|
Приклад
|
Складаємо пропорцію: 100 г розчину — Ср г р.р-ни
|
Складаємо пропорцію: 100 г р-ну – 5 г 1100 г р-ну – г
|
|
|
|
|
|
|
2. Визначення моляльної концентрації за відомою процентною концентрацією розчину
Моляльна
концентрація
![]() розраховується на 1000 г розчинника. Отже,
при розрахунку моляльної концентрації
необхідно спочатку перейти від маси
розчину до маси розчинника. Наприклад,
дається 20%-ний розчин
розраховується на 1000 г розчинника. Отже,
при розрахунку моляльної концентрації
необхідно спочатку перейти від маси
розчину до маси розчинника. Наприклад,
дається 20%-ний розчин
![]() .
Це, з одного боку, означає, що 20 г
знаходиться в 100 г розчину, а з другого,
– що 100 г розчину складається із 20 г
і 80 г
.
Це, з одного боку, означає, що 20 г
знаходиться в 100 г розчину, а з другого,
– що 100 г розчину складається із 20 г
і 80 г
![]() .
Останнє трактування дозволяє скласти
пропорцію, необхідну для розрахування
моляльної концентрації:
.
Останнє трактування дозволяє скласти
пропорцію, необхідну для розрахування
моляльної концентрації:
20 г – 80 г
Х – 1000 г
![]() г.
г.
Вираховуємо
,
тобто кількість моль
у 1000 г води, знаючи, що
![]() =39+127=166
г/моль.
=39+127=166
г/моль.
![]() моль.
моль.
3. Розрахування титру розчину за його відомою процентною концентрацією
Титр вираховується на 1 мл розчину. Тому для переходу від процентної концентрації до титру спершу потрібно вирахувати об’єм 100 г розчину, використовуючи значення насиченості цього розчину:
![]() .
.
Після цього титр розчину можна знайти за пропорцією
![]() містить Ср
г р.р-ну
містить Ср
г р.р-ну
1 мл – Х
![]() .
.
Приклад.
Вирахувати титр 40 %-ного розчину
![]() ,
густина якого дорівнює 1,307 г/мл.
,
густина якого дорівнює 1,307 г/мл.
Розв’язування. Об’єм 100 г розчину обраховуємо, використовуючи значення його густини:
![]() мл.
мл.
Складаємо пропорцію:
У 76,7 мл знаходиться 40 г
1
мл –
![]()
![]() г/мл.
г/мл.
