
- •Лекция №1
- •1) При давлении рабочего тела больше атмосферного:
- •2) При давлении рабочего тела меньше атмосферного:
- •1) Размерами молекул газа.
- •2) Силами притяжения и отталкивания между молекулами газа.
- •1) Массовыми долями;
- •2) Объемными долями.
- •Лекция №2
- •1) Кинетической энергии молекул (поступательного и вращательного движения молекул);
- •2) Колебательного движения атомов в самой молекуле;
- •3) Энергии электронов и т.Д.
- •Лекция №3
- •1) Если , то и , т.Е. При расширении работа тела положительна, при этом рабочее тело само совершает работу;
- •2) Если же , то и , т. Е. При сжатии работа тела отрицательна; это означает, что не рабочее тело совершает работу, а на его сжатие затрачивается работа извне.
- •Лекция №4
- •Лекция №5
- •Лекция № 8
Лекция №4
4.1.1 Изотермический процесс
Изотермический
процесс – это процесс подвода или отвода
теплоты от рабочего тела при постоянной
температуре рабочего тела (![]() ).
).
Запишем уравнение состояния идеального газа для начального и конечного состояний газа:
(4.1)
(4.2)
Выразим из первого и второго уравнений:
(4.3)
(4.4)
Левые части этих уравнений равны. Соответственно равны и правые части этих уравнений:
(4.5)
Поскольку мы
рассматриваем изотермический процесс,
при котором
![]() ,
то зависимость
между начальными и конечными параметрами
в изотермическом процессе следующая:
,
то зависимость
между начальными и конечными параметрами
в изотермическом процессе следующая:
![]() (4.6)
(4.6)
Формулу (3.33) можно переписать в другом виде:
![]() (4.7)
(4.7)
Запишем первый закон термодинамики:
(4.8)
Поскольку в
изотермическом процессе
![]() ,
то изменение внутренней энергии
идеального газа равно
,
то изменение внутренней энергии
идеального газа равно
![]() и вся теплота, подводимая к газу,
расходуется на совершение работы газом:
и вся теплота, подводимая к газу,
расходуется на совершение работы газом:
![]() (4.9)
(4.9)
Механическая работа определяется по формуле (35):
(4.10)
Интегрирование этой формулы при условии дает следующее выражение для работы:
![]() (4.11)
(4.11)
Однако не совсем
ясно, какое давление следует подставлять
в формулу (4.11) -
![]() или
или
![]() .
.
Поэтому, вычислить механическую работу идеального газа по формуле (4.11) не представляется возможным.
Для определения механической работы в формуле (4.10) необходимо заменить Р на его выражение из уравнения состояния идеального газа:
![]() (4.12)
(4.12)
Подставим формулу (61) в выражение (36):
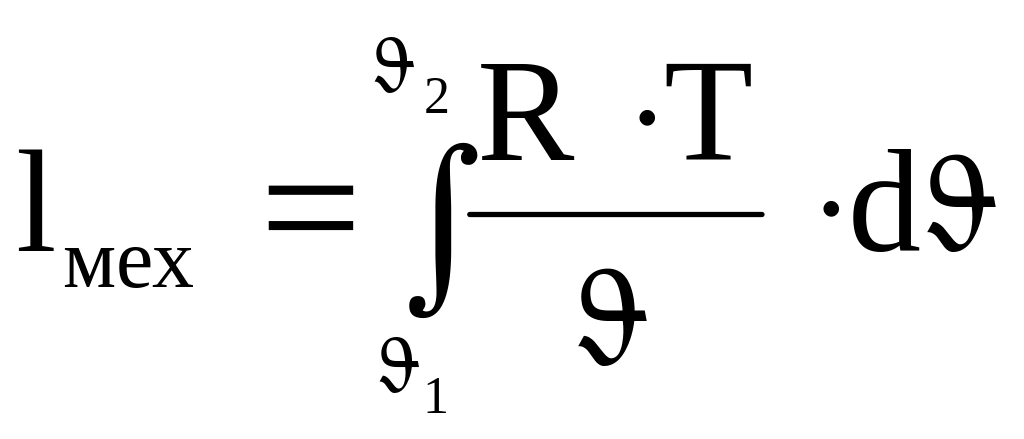 (4.13)
(4.13)
В выражении (4.13) газовая постоянная R и температура Т- константы (поскольку рассматривается изотермический процесс) и их можно вынести за интеграл:
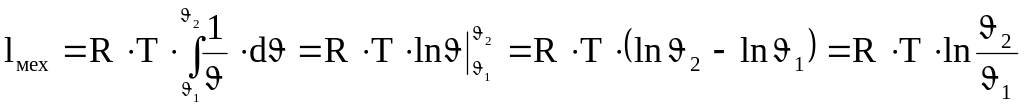 (4.14)
(4.14)
Поскольку для изотермического процесса справедливо соотношение:
(4.15)
то:
![]() (4.16)
(4.16)
В формулах (63) и
(65) в соответствии с уравнением состояния
идеального газа выражение
![]() можно заменить на
можно заменить на
![]() либо
либо
![]() .
.
4.1.2 Адиабатный процесс
Адиабатный
процесс – это процесс, происходящий
без теплообмена рабочего тела с окружающей
средой или, другими словами, без подвода
или отвода теплоты от рабочего тела
(![]() ).
).
Зависимости между начальными и конечными параметрами в адиабатном процессе следующие:
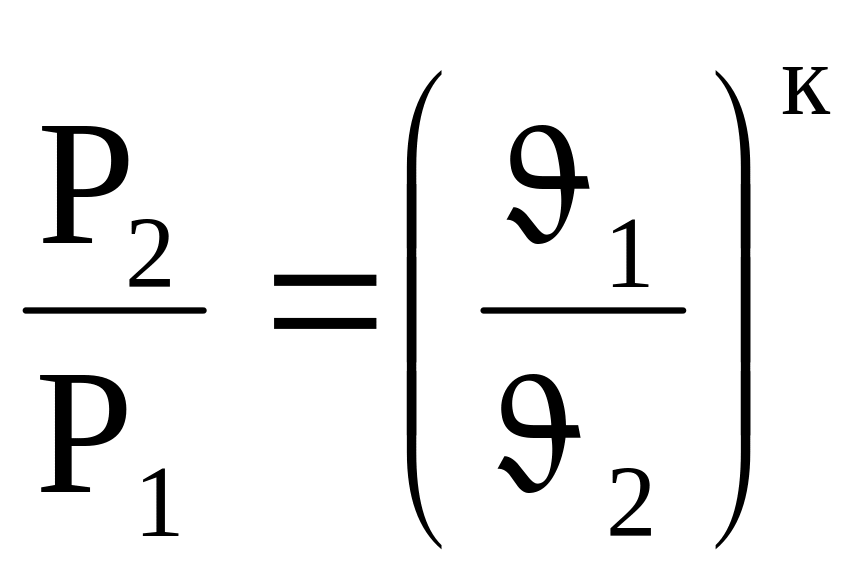 (4.17)
(4.17)
 (4.18)
(4.18)
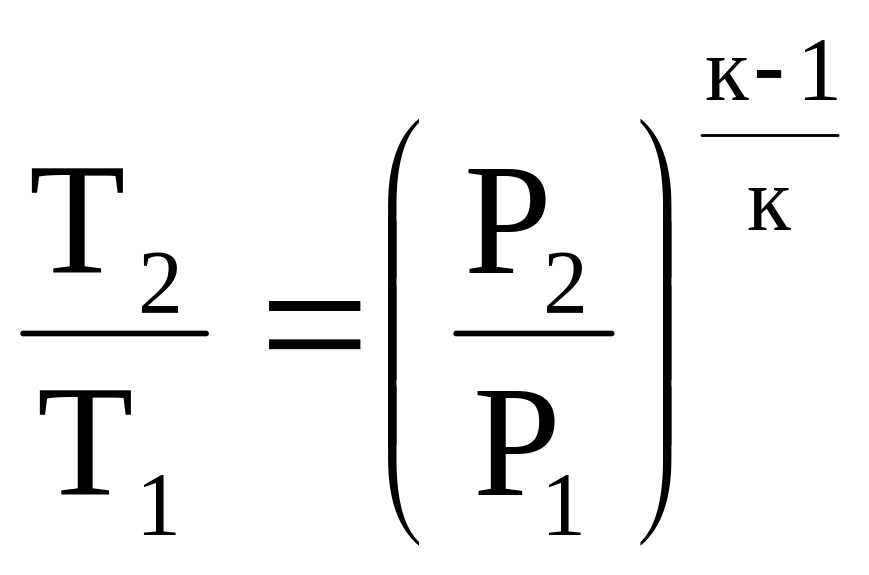 (4.19)
(4.19)
где к- показатель адиабаты:
![]() (4.20)
(4.20)
Одноатомный газ |
|
Двухатомный газ |
|
Трехатомный газ |
|
Запишем первый закон термодинамики:
(4.21)
Поскольку в
адиабатном процессе
![]() ,
то первый
закон термодинамики для адиабатного
процесса имеет следующий вид:
,
то первый
закон термодинамики для адиабатного
процесса имеет следующий вид:
![]() (4.22)
(4.22)
или:
![]() (4.23)
(4.23)
Механическую работу газа в адиабатном процессе можно определить по формулам:
![]() (4.24)
(4.24)
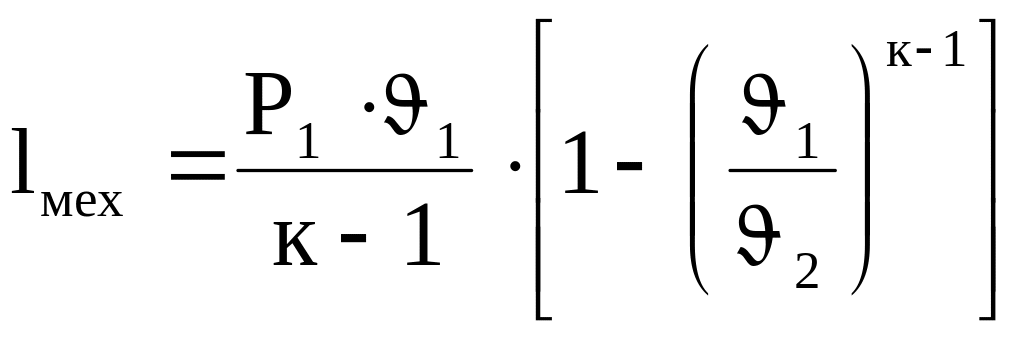 (4.25)
(4.25)
![]() (4.26)
(4.26)
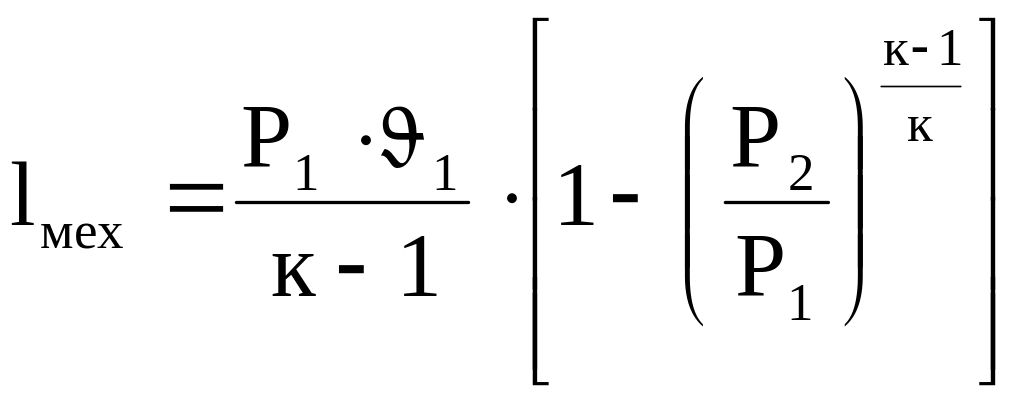 (4.27)
(4.27)
Таким образом, в адиабатном процессе рабочее тело может совершать работу только за счет уменьшения своей внутренней энергии.
4.2 Второй закон термодинамики
Первый закон термодинамики утверждает, что теплота может превращаться в работу.
Первый закон
термодинамики “позволяет” превратить
всю подведенную к рабочему телу теплоту
![]() в работу
в работу
![]() ,
что может быть осуществлено в изотермическом
процессе:
,
что может быть осуществлено в изотермическом
процессе:
![]() (4.28)
(4.28)
Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты:
![]() (4.29)
(4.29)
на величину
отведенной теплоты
![]() :
:
![]() (4.30)
(4.30)
Таким образом, для полного анализа термодинамических процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики.
Одна из формулировок второго закона термодинамики:
Д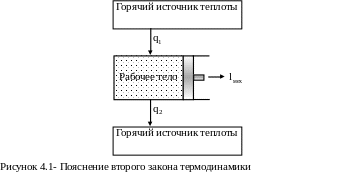 ля
существования теплового двигателя
необходимы 2 источника - горячий
источник (теплота от сгорания топлива)
и холодный источник
(окружающая
среда).
ля
существования теплового двигателя
необходимы 2 источника - горячий
источник (теплота от сгорания топлива)
и холодный источник
(окружающая
среда).
На первый взгляд кажется, что между первым и вторым законами термодинамики существует противоречие: первый закон термодинамики позволяет превратить всю подведенную к газу теплоту в работу, второй закон термодинамики- не позволяет этого сделать.
Однако, в действительности, противоречия между первым и вторым законами термодинамики не существует, потому что первый закон термодинамики говорит о термодинамическом процессе, а второй закон термодинамики говорит о термодинамическом цикле.
Для работы
теплового двигателя необходимо, чтобы
рабочее тело (газ), к которому подводится
теплота и с помощью которого совершается
работа, совершало замкнутый процесс и
возвращалось в свое п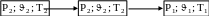 ервоначальное
состояние, т.е.:
ервоначальное
состояние, т.е.:
Этот замкнутый процесс называется круговым процессом или циклом.
Работа, как цикла, так и процесса, изображается в координатах.
1-а-2- кривая процесса расширения рабочего тела; 2-б-1- кривая процесса сжатия рабочего тела.
Площадь под кривой 1-а-2 равна работе расширения газа, площадь под кривой 2-б-1 равна работе сжатия газа, а площадь, ограниченная замкнутой кривой (кривой цикла) 1-а-2-б-1 представляет собой работу, совершаемую газом в циклическом процессе. Отсюда следует, что для того, чтобы работа, совершаемая газом в циклическом процессе, была положительной и вообще существовала, необходимо, чтобы кривая процесса сжатия газа 2-б-1 в координатах была расположена ниже кривой расширения 1-а-2.

4.3 Энтропия идеального газа
Энтропия
представляет собой функцию состояния
термодинамической системы, т.е. энтропия
зависит от параметров состояния системы,
а именно от абсолютного давления (
),
плотности (![]() )
и абсолютной температуры (
).
)
и абсолютной температуры (
).
Основным уравнением для определения изменения энтропии в обратимом процессе является выражение:
![]() (4.31)
(4.31)
Обратимыми называются процессы, в результате протекания которых в прямом и обратном направлениях в прямом и обратном направлениях термодинамическая система возвращается в исходное состояние, не вызывая при этом никаких изменений в окружающей среде (например, изменения температуры окружающей среды).
Привести пример с перемещением металлического шарика между двумя плоскостями.
Формула (4.31)
показывает, что
![]() и
и
![]() имеют одинаковые знаки, следовательно,
по характеру изменения энтропии в
обратимом процессе можно судить о том,
в каком направлении протекает процесс.
При подводе теплоты к рабочему телу
имеют одинаковые знаки, следовательно,
по характеру изменения энтропии в
обратимом процессе можно судить о том,
в каком направлении протекает процесс.
При подводе теплоты к рабочему телу
![]() его энтропия возрастает (
его энтропия возрастает (![]() ),
а при отводе теплоты энтропия рабочего
тела убывает.
),
а при отводе теплоты энтропия рабочего
тела убывает.
Поскольку в теплотехнических расчетах в основном приходится рассчитывать не саму величину энтропии термодинамической системы (рабочего тела), а ее изменение, то отсчет значений энтропии можно вести от любого состояния рабочего тела. Для газов принято считать значение энтропии равным нулю при нормальных условиях.
Определение энтропии при постоянной теплоемкости (т.е. в расчетах полагается, что теплоемкость не зависит от температуры) осуществляется по следующим формулам:
![]() (4.32)
(4.32)
![]() (4.33)
(4.33)
![]() (4.34)
(4.34)
Изменение энтропии при переходе газа из состояния 1 в состояние 2, т.е. при осуществлении термодинамического процесса определяется по следующим формулам:
![]() (4.35)
(4.35)
![]() (4.36)
(4.36)
![]() (4.37)
(4.37)
