
- •Лабораторний практикум
- •Список лабораторних робіт
- •Коротка теорія.
- •Оптична пірометрія.
- •Опис установки.
- •Виконання роботи.
- •Звіт про роботу.
- •Завдання 1 Зняття вольт – амперних характеристик фотоелементів (вах).
- •Виконання завдання
- •Завдання 2. Визначення роботи виходу електронів із металу і сталої Планка.
- •Виконання завдання. З ф ібрати електричне коло для проведення досліду згідно рис. 5
- •Звіт про виконану роботу.
- •Контрольні запитання
- •Література
- •Лабораторна робота № 3 визначення динамічних характеристик електрона.
- •Порядок виконання роботи.
- •Інструкція до виконання роботи.
- •Звіт про роботу:
- •Лабораторна робота № 4 вивчення серіальних закономірностей атомів водню і воднеподібних.
- •Коротка теорія
- •Опис установки.
- •Градуювання шкали монохроматора
- •Характеристики монохроматора ум-2 Дисперсія (д) монохроматора ум-2
- •Данні градуювання ум-2 (заводські).
- •Звіт про роботу повинен містити:
- •Література.
- •Лабораторна робота № 5 вивчення структури спектра лужних і лужноземельних елементів
- •Коротка теорія.
- •Опис установки.
- •Порядок виконання роботи
- •Звіт про виконану роботу
- •Література
- •Дослідження молекулярного спектру йоду
- •Загальні положення.
- •Енергія молекули.
- •Спектр поглинання молекули.
- •Розрахунки частот ек переходів з поглинанням енергії.
- •Розрахунки частот ліній, що утворюють смугу поглинання.
- •Завдання до лабораторної роботи.
- •Контрольні питання до роботи.
- •Звіт про виконану роботу.
- •Література.
- •Ознайомлення з будовою і дією оптичного квантового генератора (окг) неперервної дії.
- •Загальні зауваження.
- •Завдання 1
- •Виконання роботи.
- •Виконання завдання 2.
- •Звіт за виконану роботу:
- •Література
- •1. Теоретичні відомості.
- •2. Дослідна установка.
- •Джерело світла; 2. Монохроматор; 3. Фо; 4. Джерело напруги. Вх - вхідна і Вих - вихідна щілина монохроматора.
- •3. Виконання роботи.
- •Дослідна установка (рис. 7).
- •4. Наслідки роботи.
- •5. Контрольні запитання.
- •6. Література
- •Лабораторна робота № 9 вивчення фотоелектричних властивостей вентельних фотоелементів.
- •Теоретичні відомості
- •Дослід.
- •Завдання 1.
- •Завдання 2.
- •Література.
Звіт про роботу повинен містити:
1) основні положення теорії атома Н;
2) оптичну схему експериментальної установки;
3) результати виміру довжин хвиль водню і розрахунки ізотопічних зсувів;
4) розрахунок питомого заряду електрона, потенціалів іонізації;
5) спектри серій Лаймана і Бальмера в шкалі частот для Н1, з урахуванням спін-орбітальної взаємодії;
6) оцінку похибки вимірів і розрахунків.
Література.
1. Оптика и атомная физика(лабораторный практикум). Под редакцией P.И Солоухина. Новосибирск, 1976 .
2. Физический практикум: Электричество и оптика. Под редакцией В.И. Ивероновой. М., 1968.
3. И.В. Савельев. Курс общей физики. Т.3.-М., «Наука».1979
Лабораторна робота № 5 вивчення структури спектра лужних і лужноземельних елементів
Мета роботи: ознайомлення зі структурою спектрів лужних і лужнозе-
мельних елементів.
Завдання:
Знайти довжини хвиль, що відповідають лініям видимого спектра хімічного елемента в межах від 400 до 700 нм.
Визначити причетність ліній видимого спектра випромінювання до можливих серій. З’ясувати, яким переходам відповідають спостережені лінії спектру.
Встановити тонку структуру окремих ліній спектра.
Обладнання: стилометр CТ-7, спектральні лампи, джерело струму,
міліамперметр, баластний опір.
Коротка теорія.
Кожна лінія в спектрі атома характеризується довжиною хвилі λ чи хвильовим числом , а також інтенсивністю, точніше, імовірністю випромінювання спектральної лінії. Довжина хвилі спектральної лінії та імовірність випромінювання визначаються властивостями атомної системи. При зміні енергії атома відбувається випромінювання чи поглинання фотона, частота якого визначається фундаментальним співвідношенням Бора.
ħωki =Ek – Eі (1)
де Ek і Eі – значення енергії різних рівнів атомної системи.
Зміна енергії атома зв'язана зі зміною стану електрона в атомі. Енергетичні стани атома систематизуються відповідно до законів квантової механіки. Якщо на атом (молекулу) не впливають зовнішні поля чи частинки, то стани, у яких можуть знаходитися електрони, визначаються потенційним полем, створюваним зарядами частинок, що утворюють атом. Поле залишається незмінним у часі, тому такі стани називаються стаціонарними. Стаціонарним станам електрона відповідають значення енергії Е1, Е2, . . ., En.
Енергія стаціонарних станів безпосередньо зв'язана з параметрами, що характеризують будову електронної оболонки атома. Такими параметрами є величини, що визначають стан стаціонарних орбіт електронів (квантові числа). Для повного визначення стаціонарного стану електрона необхідно стільки квантових чисел, скільки ступенів вільності має електрон в атомі. Використовують п'ять квантових чисел, з яких незалежні чотири — n, l, m, ms.
Головне квантове число n визначає енергію даного стаціонарного стану за формулою Бора (чи номер шару, до якої належить електрон). Головне квантове число може приймати будь-які цілі позитивні значення n =1, 2, . . . . Усі можливі стани електрона, що характеризується тим самим головним квантовим числом, утворюють так званий електронний шар. В кожному електронному шарі може знаходитися не більш як 2n2 електронів.
Орбітальне (чи азимутальне) квантове число l визначає величину моменту кількості руху електрона на орбіті. Проекція орбітального моменту є квантованою, тобто приймає ряд дискретних значень при заданому l. Для кожної електронної оболонки, обумовленої головним квантовим числом n, можливо декілька електронів з різними орбітальними числами l =0,
 1.
2,...,
(п
– 1). Знаючи l, можна обчислити
орбітальний
момент кількості руху електрона:
1.
2,...,
(п
– 1). Знаючи l, можна обчислити
орбітальний
момент кількості руху електрона:
 (2)
(2)
Стани електронів зі значеннями l = 0, 1, 2, 3, 4, 5, 6, 7, ... прийнято позначати символічно буквами s, p, d, f, g, h, I, k.Ці стани відповідно називаються s-станами, р-станами і т.д.
Енергетичні рівні, яким відповідає кілька різних станів, називаються виродженими (кратними). Такий енергетичний рівень можна представити складеним з декількох простих рівнів. Число, що показує, якій кількості різних станів відповідає однакова енергія, указує кратність виродження і називається статистичною вагою рівня, яка позначається літерою g.
3. Орбітальне магнітне квантове число m визначає проекцію орбітального моменту кількості руху на вибраний напрямок (в напрямі зовнішнього магнітного поля). Іншими словами, число m визначає просторову орієнтацію орбіт. Воно може приймати при заданому l цілочисленні значення m = 0, ±1, ±2, ±3,. . . , ± l, тобто для кожного заданого значення l можливі (2 l +1) значень m і, отже, стільки ж різних станів електрона.
4. Спінове квантове число s інтерпретується як характеристика власного моменту кількості руху електрона. Проекція спінового моменту електрона на обраний напрямок може приймати лише два значення: ms=± , тобто в полі спін електрона розташовується в напрямі поля чи протилежному . Відповідно до принципу Паулі, в атомі не може бути двох чи більш електронів, усі квантові числа яких однакові. Звідси випливає закон розподілу електронів по квантових станах.
Наприклад, при l = 0 можливі два s -електрони, l = 1 - не більше шести р-електронів, l= 2 - не більше десяти d-електронів і т.д.
В таблиці 1 наведені можливі значення квантових чисел l, m i s для s, p i d підгруп.
Таблиця 1 .
l |
m |
ms |
Число електронів |
Підгрупа |
0 |
0 |
+1/2 –1/2 |
2 |
s |
1 |
+1 0 –1 |
+1/2 –1/2 +1/2 –1/2 +1/2 –1/2 |
6 |
p |
2 |
+2 +1 0 –1 –2 |
+1/2 –1/2 +1/2 –1/2 +1/2 –1/2 +1/2 –1/2 +1/2 –1/2 |
10 |
d |
Сукупності електронних станів із заданим значенням n будь-якими можливими значеннями l, m, s утворять конкретний електронний шар (оболонку). Конфігурація електронів символічно фіксується шляхом послідовного написання символів для всіх електронів. Для атомів з одним валентним електроном стан електрона визначає і стан атома. Тому стан такого атома може бути позначено тим же символом, що і стан електрона. Наприклад, 11 електронів Na складають конфігурацію 1s2 2s2 2p6 3s1 . Числа праворуч зверху від символів l позначають число електронів, що мають дані значення n і l. Атоми більшості речовин — багатоелектронні системи. Електрони в них знаходяться в усередненому електричному полі, створюваному ядром і іншими електронами. Тому електронна конфігурація в багатоелектронних атомах та іонах визначається сумарними квантовими числами, що залежать від типу взаємодії між електронами. Для атомів з невеликим числом валентних електронів справедлива схема додавання моментів по Расселу — Саундерсу. У цьому випадку загальний орбітальний момент кількості рухів всієї електронної оболонки визначається правилом:
 (3)
(3)
Для будь-якої
замкнутої електронної оболонки
s2:p6:dl0:f14,…загальний
орбітальний момент
 .
Cтани атома чи іона зі
значеннями L= 0, 1, 2, 3, 4. 5. 6, 7,... позначаються
великими буквами S, P, D, F, G, H, I,.... Сумарний
спіновий момент електронної оболонки
визначається правилом:
.
Cтани атома чи іона зі
значеннями L= 0, 1, 2, 3, 4. 5. 6, 7,... позначаються
великими буквами S, P, D, F, G, H, I,.... Сумарний
спіновий момент електронної оболонки
визначається правилом:
 (4)
(4)

Рис. 1 Векторна модель складного атома
Моменти
 складаються
векторно в повний момент атома
складаються
векторно в повний момент атома
 (рис.1) і т.д.:
(рис.1) і т.д.:
 (5)
(5)
Числові значення результуючих моментів знаходяться через квантові числа L, S, J у такий спосіб :

Квантове число L
приймає значення, що відрізняються один
від одного на одиницю в межах між
 .
.
Аналогічним чином квантове число S може приймати значення, що відрізняються на одиницю в межах між максимальним і мінімальним значенням суми.
Внутрішнє квантове число J, що визначає результуючий повний момент завдяки можливої різної орієнтації векторів приймає одне зі значень J=L+S, (L + S – 1),...|L-S|. Число різних значень J при L > S дорівнює (2S +1) і при L < S дорівнює (2L + 1). Величина сумарного спінового моменту визначає кратність термів χ, їх мультиплетність:
 (7)
(7)
При L > S число J може приймати різних значень, кожному з яких відповідають різні енергії їхньої взаємодії, внаслідок чого кожен рівень для даних L, S дає мультиплетне розщеплення на підрівнів. При L < S маємо розщеплення на (2L + 1) підрівнів.
Приведений тип
міжелектронної взаємодії називається
[L - S] зв'язком, він найбільш розповсюджений.
Квантові числа L і J цілком визначають
стан атома (спектроскопічний терм
Рассела – Саундерса), що символічно
записується у вигляді
 .
Біля символу термa L=S, P, D, F, G, . . . ліворуч
угорі ставиться індекс мультиплетності,
праворуч знизу — значення числа J,
праворуч угорі — значок непарності
терма (0), якщо
арифметична сума
.
Біля символу термa L=S, P, D, F, G, . . . ліворуч
угорі ставиться індекс мультиплетності,
праворуч знизу — значення числа J,
праворуч угорі — значок непарності
терма (0), якщо
арифметична сума
 є
непарне число.
є
непарне число.
Серед станів атома мається такий, у якого енергія мінімальна — це стан стійкої рівноваги. Система, виведена з подібного стану, буде прагнути повернутися у вихідний стан рівноваги. Квантово-механічний стан з найменшою енергією називається основним чи нормальним. У діаграмах енергетичних рівнів атома енергія основного стану звичайно приймається за початок відліку. Інші стани вважаються збудженими. Збуджені стани нестійкі. Під дією збурювань квантова система зі збудженою стану прагне перейти в основний стан.
Для визначення основного стану атома використовують правила Гунда. Відповідно до першого правила Гунда, терм основного стану завжди має максимальну мультиплетність. Відповідно до другого правила Гунда, із двох станів з однаковою мультиплетністю більш стійкий стан з більшим значенням L. Сукупність усіх можливих енергетичних станів ще не визначає реального енергетичного спектра. Система може переходити з одного енергетичного стану в інший зі стрибкоподібною зміною енергії. Такі переходи називаються квантовими переходами. При переході з високого енергетичного стану з енергією Ек у стан з меншою енергією Еi система віддає енергію, рівну Ек — Еi , а при зворотньому переході поглинає її. Для енергії, що випромінюється чи поглинається у вигляді електромагнітних хвиль частоти ωki справедливий фундаментальний закон (1). Однак не всі переходи з одного енергетичного стану в інший можливі. Переходи поділяються на дозволені і заборонені. У квантовій механіці знайдені правила добору, що дозволяють установити ті чи інші переходи. Заборонені і дозволені переходи характеризуються величиною імовірності переходу. Якщо імовірність переходу мала, то такий перехід вважається забороненим. Якщо всі квантові переходи з деякого верхнього рівня на нижні рівні правилами добору заборонені, то такий рівень, будучи збудженим, може існувати тривалий час. Подібні рівні називають метастабільними Метастабільні стани відіграють істотну роль в оптичних квантових генераторах (лазерах).
Система може випромінювати квант енергії у вигляді фотона або передати надлишок енергії іншим атомам чи навколишньому середовищу у вигляді теплової енергії (зіткнення атомів, зі стінками газорозрядних трубок, передача енергії кристалічним ґраткам у твердих тілах). У першому випадку перехід називається випромінювальним, у другому – безвипромінювальним. Дозволені переходи можуть дати випромінювання і поглинання на частотах, обумовлених формулою (1). Сукупність частот цих переходів і складає основний енергетичний спектр випромінювання.
Між різними станами атома (чи іона) при даній електронній конфігурації можуть мати місце переходи, що задовольняють правилам добору:
 (8)
(8)
к рім
випадків J1 =
0 → J2 =
0). Випромінювання чи поглинання
спектральних ліній може відбуватися
при переході атомної системи між термами
різної парності. Тому переходи між
термами однієї парності звичайно
відповідають слабким спектральним
лініям. Слід зазначити, що крім найбільш
розповсюдженого типу [L – S] зв’язку
електронів існують і інші типи взаємодій.
Для атомів з великим числом валентних
електронів справедливий такий тип
взаємодії між електронами, коли повні
моменти кожного електрона
рім
випадків J1 =
0 → J2 =
0). Випромінювання чи поглинання
спектральних ліній може відбуватися
при переході атомної системи між термами
різної парності. Тому переходи між
термами однієї парності звичайно
відповідають слабким спектральним
лініям. Слід зазначити, що крім найбільш
розповсюдженого типу [L – S] зв’язку
електронів існують і інші типи взаємодій.
Для атомів з великим числом валентних
електронів справедливий такий тип
взаємодії між електронами, коли повні
моменти кожного електрона
 складаються в результуючий повний
момент, т.т.
складаються в результуючий повний
момент, т.т.

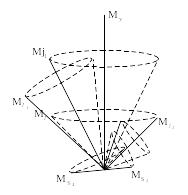
(рис. 2)
Тип взаємодії, що відповідає такій схемі додавання моментів, називається (j–j) – зв'язком. Він характерний для збуджених станів атомів з великим числом електронів. Крім (L–S) і (j–j) зв’язків електронів в атомі існують ще проміжні зв'язки, що відповідають проміжним схемам додавання моментів. Сукупність можливих стаціонарних станів атома (іона і молекули) прийнято зображувати графічно у вигляді діаграм енергетичних рівнів. Діаграма енергетичних рівнів являє собою рисунок, на якому у визначеному масштабі по вертикалі роздільними горизонтальними лініями показані значення енергії, якими може володіти атом. Кожний з енергетичних рівнів маркується спеціальним символом, що дозволяє установити найважливіші параметри енергетичних станів атома. Ці рівні і відстані між ними різні для різних хімічних елементів, але однакові для всіх атомів елемента, хоча рівні ізотопів одного елемента трохи зміщені. Діаграма енергетичних рівнів є індивідуальною характеристикою даного типу квантової системи. Лінії, що з'єднують окремі рівні, дають наглядне уявлення про спектральні переходи випромінюючих атомів при стрибкоподібній зміні енергії атому від стану, що характеризується верхнім термом, до стану, що характеризується нижнім термом. На рис. 3 приведена діаграма енергетичних рівнів нейтрального атома натрію Na11 . Там же приведені довжини хвиль деяких спектральних ліній, які випромінюються або поглинаються атомом при переході електронів з одного енергетичного стану в інший. З рис. 3 видно, що мають місце групи послідовних ліній, які йдуть з більш високих енергетичних рівнів і які відрізняються положенням електрона із зростаючими значеннями головного квантового числа n. Такі послідовності спектральних ліній називаються спектральними серіями.
Серійні закономірності спостерігаються у спектрах атомів з одним, двома і більше валентними електронами. тобто в лужних, лужноземельних елементах і т.д.
Атом лужного металу являє собою складну систему, що складається з ядра, внутрішніх електронних шарів зовнішнього (валентного) електрона. (Z–1) електронів лужного атома разом з ядром утворюють стійкий «кістяк» (атомний залишок), що нагадує ядро з зарядом Z=1. Припускаючи, що зовнішній електрон знаходиться на досить великій відстані від ядра, атом лужного елемента розглядають як деяку «водне-подібну» систему (зовнішній електрон і атомний «залишок»), де в полі ефективного заряду Zеф рухається слабко зв’язаний електрон. Однак «ефективне ядро» атомів лужних елементів аж ніяк не незмінна система. Якщо в полі точкового заряду рівні енергії вироджені (наприклад, рівні енергії з однаковим головним квантовим числом п у водню усі вироджені), то в лужних атомів завдяки збурюванню, викликаним деформацією електронного кістяка, виродження рівнів енергії знімається. Крім того, усі лінії лужних елементів являють собою дублети, дуже вузькі у літію, трохи ширше в натрію, причому тим ширше, чим більше атомна вага елемента. Таке розщеплення термів випливає із гіпотези про власний механічний момент електрона – спін, який може орієнтуватися відносно орбітального моменту тільки двома способами, що відповідає двом значенням додаткової енергії.
Розгляд атома лужного елемента в якості деякої «воднеподібної» системи, у якій враховується вплив зовнішнього збурювання, що накладається на кулонівське притягання атомного залишку, приводить до виразу для енергії, аналогічному виразу для енергії атома водню:
 (11)
(11)

Рис.3 Схема енергетичних рівнів атома натрію
Дуже часто в літературі можна зустріти історично сформовану форму запису виразу для енергії атомів лужних металів:
 (12)
(12)
де
 Величина σ1 негативна
і зветься поправкою Рідберга, вона по
абсолютній величині більше σ2,
названою поправкою Рітца. Квантовий
дефект дорівнює ∆ = |σ|.
Розходження з атомом водню полягає в
тому, що ефективне квантове число nеф
– не ціле число, як у водню, а
відрізняється від відповідного значенням
головного квантового числа водню на
величину ∆, що уявляє собою правильну
дріб. Величина квантового дефекту в
основному визначається значенням
орбітального квантового числа l
(залежність від головного квантового
числа п дуже слабка, від l — дуже
сильна) : при даному п квантовий дефект
різко зменшується при збільшенні
орбітального квантового числа l. У
спектрах лужних елементів існує декілька
частково перекриваючих серій спектральних
ліній із систематично зменшувальними
відстанями між лініями і зі зменшуваною
інтенсивністю. Як і в спектрі водню,
частоти ω, що відповідають
лініям кожної серії, можуть бути описані
загальною серіальною формулою, названою
формулою Рідберга:
Величина σ1 негативна
і зветься поправкою Рідберга, вона по
абсолютній величині більше σ2,
названою поправкою Рітца. Квантовий
дефект дорівнює ∆ = |σ|.
Розходження з атомом водню полягає в
тому, що ефективне квантове число nеф
– не ціле число, як у водню, а
відрізняється від відповідного значенням
головного квантового числа водню на
величину ∆, що уявляє собою правильну
дріб. Величина квантового дефекту в
основному визначається значенням
орбітального квантового числа l
(залежність від головного квантового
числа п дуже слабка, від l — дуже
сильна) : при даному п квантовий дефект
різко зменшується при збільшенні
орбітального квантового числа l. У
спектрах лужних елементів існує декілька
частково перекриваючих серій спектральних
ліній із систематично зменшувальними
відстанями між лініями і зі зменшуваною
інтенсивністю. Як і в спектрі водню,
частоти ω, що відповідають
лініям кожної серії, можуть бути описані
загальною серіальною формулою, названою
формулою Рідберга:
 (13)
(13)
де nеф= n + σ ефективні квантові числа.
У спектрах лужних елементів існують серії ліній, які розташовані в ультрафіолетовій, видимій і інфрачервоній областях спектра.
1. Головна серія, що являє собою переходи з р-рівнів на основний рівень ns. Змінним термом є Р-терм. Позначення термів походить від назви серії «principale»— головний. Символічно для натрію ця серія записується у вигляді:
 (14)
(14)
або
 (15)
(15)
де n=3,4,5... . Ця серія спостерігається також і в спектрах поглинання, виявляючи велику подібність зі спектрами поглинання водневого атома (серія Лаймана).
2. Перша побічна, чи дифузійна, серія з розмитими лініями являє собою переходи з найбільш глибокого p-рівня на d-рівні. Змінним термом є D-терм. Позначення термів походить від назви серії «diffuse» -розмитий. Схема структури цієї серії для натрію виражається так:
 (16)
(16)
 (17)
(17)
де n=4, 5,... .
3. Друга побічна, чи різка, серія з різко обкресленими краями ліній являє собою переходи з найбільш глибокого р-рівня на s-рівні. Змінним термом є S-терм. Позначення термів походить від назви «sharp»— різкий. Символічно серія для натрію мас вигляд:
 (18)
(18)
або
 (19)
(19)
де n=4, 5,... . Інтенсивності ліній відносяться як 2:1.
4. Серія Бергмана, чи фундаментальна серія, являє собою переходи між найбільш глибоким d-рівнем і f-рівнями. Змінним термом є F-терм. Позначення терма походить від назви серії «fundamental» — фундаментальна. Схема структури ліній серії натрію має вигляд:
 (20)
(20)
або
 (21)
(21)
де n=4,5,... . Серія Бергмана розташована в інфрачервоній області спектра. У приведених формулах величини s,p,d,f – деякі параметри, що мають постійні значення для кожної серії. Серії складені так, щоб переходи між термами підкорялися правилу добору для квантових чисел L і J, установлених шляхом обчислення імовірностей переходів:
∆J = 0, ± 1; ∆L = ± 1 (22)
У результаті лінії
головної і другої побічних серій —
подвійні, а лінії інших серій (перша
побічна, серія Бергмана) утворюють більш
складні групи з трьох ліній. Оскільки
для елементів з одним валентним електроном
внутрішнє квантове число приймає
значення
 при l =0;
при l =0;
 при l >0, то всі
терми атомів лужних елементів подвійні
(дублети), крім S-терма, що
не розщеплюється (рис.4). Назва «дублет»,
«дублетний» визначається наявністю
двох можливих орієнтацій спіна. Як і в
атомі водню, дублетне розщеплення
спектральних ліній лужних елементів і
дублетна структура спектральних термів
визначаються магнітною взаємодією
орбітального і спінового моментів
електрона, тобто спін-орбітальною
взаємодією і релятивістськими ефектами.
при l >0, то всі
терми атомів лужних елементів подвійні
(дублети), крім S-терма, що
не розщеплюється (рис.4). Назва «дублет»,
«дублетний» визначається наявністю
двох можливих орієнтацій спіна. Як і в
атомі водню, дублетне розщеплення
спектральних ліній лужних елементів і
дублетна структура спектральних термів
визначаються магнітною взаємодією
орбітального і спінового моментів
електрона, тобто спін-орбітальною
взаємодією і релятивістськими ефектами.
Ширина дублетного розщеплення ∆El,s може бути оцінена, виходячи з виразу для енергії спін-орбітальної взаємодії водородоподібних атомів з додатковою енергією:

 (23)
(23)

Рис. 4 Дублетне розщеплення термів атомів лужних металів
Для лужних елементів формула (23) узагальнюється шляхом заміни заряду ядра Z ефективним зарядом:
Zеф = (Z – a′) (24)
де а'— постійна екранування. Додаткова енергія спін — орбітальної взаємодії для лужних елементів рівня:
 (25)
(25)
де величина:
 (26)
(26)
називається постійною розщеплення, а
 (27)
(27)
є постійна тонкої структури.
Для двох дублетних рівнів, на які розщеплюється даний терм лужного елемента, внутрішнє квантове число j приймає два значення: j =l + і j=l– . Тоді енергії, що відповідають цим значенням j, є:
 для j=l
+
для j=l
+
 для j=l
–
для j=l
–
Величини
 і
і
 визначають зрушення дублетних рівнів
унаслідок спін — орбітальної взаємодії.
Відстань між дублетними рівнями, виражена
по шкалі частот (∆ω)
визначається за формулою:
визначають зрушення дублетних рівнів
унаслідок спін — орбітальної взаємодії.
Відстань між дублетними рівнями, виражена
по шкалі частот (∆ω)
визначається за формулою:
 (28)
(28)
Формули (24) і (28) можна використовувати для визначення величини ефективного заряду Zеф і постійної екранування а'.
Для атомів із двома валентними електронами, до яких належать гелій, лужноземельні елементи, а також цинк, кадмій і ртуть, структура термів ускладнюється. На відміну від одного дублетного терма для лужних елементів виходить дві системи термів: система синглетних (одиночних) термів (S=0, L=J) і система триплетних термів (S=1; J=L+l, L, L-1 ).
Аналіз спектрів випромінювання і поглинання кожного елемента в ультрафіолетовій, видимій і інфрачервоній областях спектра дозволяє скласти повну схему можливих термів і переходів. Символи термів містять вказівку про мультиплетність χ=2S+l в показнику ліворуч зверху символу терма, а квантове число загального моменту імпульсу J — праворуч, знизу терма. Наприклад, символічний запис 3P0, 3P1, 3P2 означає триплетний терм з орбітальним квантовим числом L=1 і спіновим S=1. Мультиплетність χ = 3. При цьому L і S комбінуються так, що J=0, 1, 2. Одиночні — синглет-терми символічно позначаються через 1S0, 1P1, 1D2 , для них χ = 1. При переходах між термами для кожної даної системи(синглетної чи триплетної) існують правила добору, обумовлені формулами (22). Синглетні терми комбінуються один з одним і утворюють серії, аналогічні серіям атомів лужних елементів, що складаються з одиночних ліній. Так само як і в спектрах лужних елементів, ці серії часто називають головною, різкою, дифузійною і фундаментальною. Триплетні терми також комбінуються між собою (триплетно-триплетні переходи) і виникають серії, аналогічні серіям лужних металів з тими ж назвами. Лінії, зв'язані з переходами між термами триплетної системи, являють собою триплети (головна і різка серії) і секстети (шість ліній) у дифузійних фундаментальних серіях.
У межах кожної із систем термів правилами добору дозволені переходи наступних типів:
Синглетні переходи Триплетні переходи
1S0–1P1 3S1–3P012
1P1–1S0 3P012 –3S1
1P1–1D2 3P012–3D123
1D2–1F3 3D123–3F234
Крім зазначених переходів існують ще так звані інтеркомбінаційні переходи між синглетними і триплетними термами.
Спектри атомів цинку, кадмію і ртуті дуже схожі між собою. Основний стан їх ns 2S0 — найглибший терм. (В додатку приведена діаграма рівнів і переходів для атомів ртуті).
Залежність енергії атома від квантового числа J при певних L і S визначає триплетне розщеплення. Причиною триплетного розщеплення є, як і у випадку дублетного, магнітна взаємодія спінових і орбітальних моментів. Енергія спін — орбітальної взаємодії при нормальному [L—S]-зв'язку виражається загальною формулою:
 (29)
(29)
де ξ(L, S) – фактор мультиплетного розщеплення, що залежить від значень L і S, і визначає абсолютну величину мультиплетного розщеплення. Відстань між сусідніми рівнями, що характеризуються квантовими числами J і J+1, дорівнює:
∆ЕJ, J+1= ξ(L, S)(J + 1) (30)
тобто пропорційна великому квантовому числу J . Це співвідношення називається правилом інтервалів тонкого (мультиплетного) розщеплення.
Загальна ширина мультиплетного терма, тобто відстань між рівнями с J = L+S та J = L – S, складає ξ(L, S)(2L + 1)S при L ≥ S і ξ(L, S)(2S + 1)L при L·> S.
У відповідності зі схемою термів і переходів в атомах цинку, кадмію і ртуті треба звернути увагу на наступну обставину: для великих атомних номерів мультиплетне розщеплення через сніп електрона (природне розщеплення терма) має великі значення. Наприклад, триплетний терм ртуті 6 3P0, 1, 2 має розщеплення в декілька електрон вольт, а складові триплету лежать у різних областях видимого спектра:
ω
= . λ
= 5460.73 Å
. λ
= 5460.73 Å
ω
= . λ
= 4358.33 Å
. λ
= 4358.33 Å
