
- •Матеріали
- •Характеристика
- •План-конспект лекції
- •Механізм газової (хімічної) корозії.
- •План-конcпект лекції
- •План-конcпект лекції
- •1. Методика розв’язування задач з хімії з використанням міжпредметних зв’язків і міжнародної системи одиниць.
- •2. Деякі недоліки у використанні розрахунків і в методиці розв’язування задач.
- •3. Використання розрахункових задач на уроках хімії.
- •План-конcпект лекції
- •Поліуретанові лакофарбові матеріали.
- •1.Поліуретанові лакофарбові матеріали.
- •2.Двохкомпонентні поліуретанові лакофарбові матеріали
- •3.Однокомпонентні поліуретанові лакофарбові матеріали, які затверджуються при нагріванні.
- •4.Однокомпонентні поліуретанові лаки і емалі, які затверджуються вологою повітря.
- •Уралкідні лакофарбові матеріали.
- •6.Властивості і застосування поліуретанових лакофарбових матеріалів.
- •План виховного заходу
- •«Наркотики : міфи і правда»
- •План позааудиторного заходу
- •«Посвячення в хіміки»
- •Посвячення в хіміки
- •Психологічний тест
- •"Наскільки ви товариська людина?"
- •Хід заходу
План-конспект лекції
в групі Х-41
студенткою-практиканткою V курсу
Майоровою Русланою Русланівною
з курсу «Корозія металів»
на тему:
«Хімічна (газова) корозія металів»
Івано-Франківськ
2013 р.
Тема: Хімічна (газова) корозія металів.
Мета: Розглянути механізм газової (хімічної) корозії; газову корозію конструкційних металів і сплавів; захист від газової корозії.
Тип заняття: лекція.
Механізм газової (хімічної) корозії.
Поверхня металу навіть при звичайних температурах, при зіткненні з повітрям покривається шаром оксидних сполук. Передбачають, що реакція окиснення металу протікає по схемі:
Ме
+
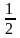 О2
↔ МеО
О2
↔ МеО
причому реакція протікає в сторону утворення оксиду при умові, коли парціальний тиск кисню повітря більший, ніж пружність дисоціації МеО інакше реакція буде протікати у зворотному напрямі.. Пружність дисоціації оксидів металів залежить як від роду металу, так і від температурних умов.
Підвищення температури, як правило, викликає збільшення швидкості окиснення металів.
Оксидні плівки, які утворюються на поверхні металів в процесі їх окиснення в багатьох випадках володіють захисними властивостями. Це пояснюється тим, що плівки мають більш позитивний потенціал, ніж метали із яких вони утворилися. Щоб оксидна плівка володіла захисними властивостями, вона повинна бути суцільною, не руйнуватися в агресивному середовищі, добре щеплюватися з основним металом; значення відносного температурного коефіцієнта лінійного розширення плівки і металу повинні бути близькими. Якщо оксидна плівка пориста, рихла і характеризується поганим щепленням з більш глибокими шарами металу, то навіть при умові інертності її в агресивному середовищі, вона не буде володіти захисними властивостями.
Товщина плівки, що утворюється при взаємодії металу з сухим повітрям, або окислювачами, залежить від роду металу, характеру середовища, температури і інших факторів.
По товщині плівки можна розділити на:
Тонкі невидимі плівки (товщина менше 400 А0);
Плівки середньої товщини (400А0 – 5000 А0);
Товсті плівки (товщина більше 5000 А0).
Основною умовою гальмування процесу подальшого окиснення металу є безпористість плівки. Можливість утворення такої суцільної плівки визначається співвідношенням об’ємів утвореного оксиду і окислюваного металу. Якщо об’єм хімічної сполуки (наприклад оксиду VМеО), яка є матеріалом виникаючої плівки менший об’єму металу VМе із якого утворилася ця сполука, тобто VМеО< VМе, то може утворюватися несуцільна пориста плівка, яка володіє слабкими захисними властивостями. Навпаки, при VМеО> VМе може утворюватися суцільна плівка, яка може захистити метал від корозії.
Швидкість газової корозії, крім температури, в більшій мірі залежить від багатьох факторів, таких як
складу газового середовища;
природи сплаву;
способу термічної і механічної обробки металу;
наявності напружень в металі;
швидкості руху газового потоку і ін.
Наприклад, відомо, що значення відносного температурного коефіцієнта лінійного розширення для металів значно більший ніж для їх оксидів. По цій причині при різких перепадах температури в плівці утворюються додаткові внутрішні напруження, які викликають розтріскування захисного шару і оголення поверхні металу (швидкість окиснення при цьому зростає). Саме цим пояснюється різке прискорення газової корозії при перемінному нагріванні і охолодженні металічних виробів. В хімічній промисловості такі явища можуть спостерігатися при експлуатації колчеданних і інших печей при недостатньо правильному регулюванню температури.
Процеси газової корозії вуглецевих сталей зв’язані не тільки з окисленням металу, але і з явищем обезвуглецювання, яке відбувається при високій температурі. При обезвуглецюванні вуглецевої сталі протікають наступні реакції:
Fe3C + O2 → 3Fe + CO2
Fe3C + CO2 → 3Fe + 2CO
Fe3C + H2O→ 3Fe + CO + H2
Обезвуглецювання викликає зменшення механічної міцності, особливо зниження межі стомленості; це слід враховувати, коли вироби підлягають знакоперемінним навантаженням.
При газовій корозії чавуну іноді збільшується об’єм, або відбувається, як говорять, «ріст чавуну». Це пояснюється проникненням через мілкі тріщини корозійно активних газів, які окислюють чавун. Оксиди займають об’єм більший чим метал, з якого вони утворилися, і в чавуні появляються багато численні тріщини. Особливо сприяє росту чавуну перемінне нагрівання і охолодження в результаті чого міцність чавуну різко падає.
Швидкість газової корозії можна знизити змінюючи склад атмосфери, наприклад створюючи інертну атмосферу. Так можна знешкодити шкідливий вплив СО2 змінюючи умови згорання палива таким чином, щоб одержати безпечні співвідношення концентрацій СО і СО2.
Кольорові метали і сплави також підлягають газовій корозії при підвищених температурах. Особливо швидко окислюються при високих температурах Zn, Cd, Pb. Із-за низької температури плавлення ці метали знайшли обмежене застосування при температурах >1500С.
Велике практичне значення, дякуючи жаростійкості, мають такі конструкційні матеріали, як Al, Cu, Ni, Ti і сплави цих металів.
При високих температурах Al покривається дуже тонкою, володіючою хорошими захисними властивостями, плівкою, стійкою навіть при температурі плавлення Al. Однак різке погіршення механічних властивостей алюмінію і його сплавів при високих температурах не дозволяє застосовувати ці матеріали. В зв’язку з цим в агресивному газовому середовищі Al можна використовувати тільки до 300 – 4000С.
Мідь окислюється при температурі вище 4000С. Залежність швидкості корозії міді від часу при 4000С і вище підкоряється параболічному закону. При температурі вище 10650С утворена при окислені на повітрі евтектика Сu – CuO плавиться. При легуванні міді Al і Ве її жаростійкість і жароміцність збільшується.
Агресивність одних і тих самих газових середовищ неоднакова для різних металів. Так, нікель зовсім нестійкий в атмосфері H2S навіть при невисоких температурах, в той час як алюміній достатньо стійкий в цих умовах, а мідь в атмосфері H2S абсолютно стійка навіть при 700-8000С.
Нижче приведені значення в % швидкості газової корозії вуглецевої сталі в деяких технічних газових середовищах в порівнянні зі швидкістю корозії в чистому повітрі, прийнятій за 100%.
Чисте повітря 100
Повітря, 2% SO2 115
Повітря, 5% Н2О 135
Повітря, 5% Н2О, 5% SO2 276
Для захисту металів від газової корозії можна застосовувати різні способи. Найбільш ефективним способом захисту від окислення при високих температурах є жаростійке легування, тобто введення в склад сплаву компонентів, які підвищують його жаростійкість. Основні елементи, які сприяють створенню захисного шару на звичайних залізовуглецевих, нікелевих і інших сплавах—це Cr, Al і Si. Ці елементи легше окислюються при високих температурах на повітрі, чим основний метал, і утворюють більш стійку окалину.
Студент ______________ Майорова Р.Р.
(підпис)
«Затверджую»
Методист ___________________ Беженар В.П. __________________
(підпис) (оцінка)
