
- •Міністерство освіти і науки України
- •Методичні вказівки
- •Передмова
- •Тема 1. Основні поняття та закони хімії
- •Визначення відносних молекулярних та молярних мас газоподібних речовин Варіанти завдань
- •Хімічний еквівалент. Закон еквівалентів Варіанти завдань
- •Тема 2. Будова атома. Періодичний закон і періодична система елементів з погляду будови атома
- •Варіанти завдань
- •Тема 3. Хімічна кінетика і рівновага
- •3.1. Швидкість хімічних реакцій Варіанти завдань
- •3.2. Хімічна рівновага. Зміщення рівноваги. Принцип Ле Шательє Варіанти завдань
- •Тема 4. Розчини. Способи вираження складу розчинів Варіанти завдань
- •Тема 5. Реакції обміну в розчинах електролітів
- •Варіанти завдань
- •Тема 6. Дисоціація води. Водневий показник Варіанти завдань
- •Тема 7. Гідроліз солей
- •Варіанти завдань
- •Тема 8. Окисно-відновні реакції
- •Варіанти завдань
- •Тема 9. Ряд стандартних електродних потенцалів металів
- •Варіанти завдань
- •Тема 10. Гальванічні елементи Варіанти завдань
- •Тема 11. Корозія металів і захист від корозії Варіанти завдань
- •Тема 12. Твердість води Варіанти завдань
- •Тема 1. Основні поняття та закони хімії
- •Тема 2. Будова атома. Періодичний закон
- •Тема 3. Хімічна кінетика і рівновага
- •Розв’язок
- •Розв’язок
- •Тема 4. Розчини. Способи вираження складу розчинів
- •Розв’язок
- •Розв’язок
- •Тема 5. Реакції обміну в розчинах електролітів
- •Розв’язок
- •Тема 6. Дисоціація води. Водневий показник
- •Розв’язок
- •Розв’язок
- •Тема 7. Гідроліз солей
- •Розв’язок
- •Розв’язок
- •Тема 8. Окисно-відновні реакції
- •Розв’язок
- •Розв’язок
- •Тема 9. Ряд стандартних електродних потенцалів металів
- •Розв’язок
- •Тема 10. Гальванічні елементи
- •Розв’язок
- •Розв’язок
- •Тема 11. Корозія металів і захист від корозії
- •Розв’язок
- •Тема 12. Твердість води
- •Розв’язок
- •Література
Тема 2. Будова атома. Періодичний закон
І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ З ПОГЛЯДУ
БУДОВИ АТОМА
Завдання 1. Орбітальне квантове число l = 2.Скільки значень магнітного квантового числа можливо для даного підрівня?
Розв’язок
Магнітне квантове число m приймає значення: -1; 0; +1.
Якщо l = 2, то m = -2, -1; 0; +1; +2.
Завдання 2. Скласти електронну формулу для елемента з порядковим номером 23. Скільки протонів і нейронів в його ядрі?
Розв’язок
Елемент з порядковим номером 23 - це Ванадій V.
Ванадій знаходиться в 4-му періоді, в побічній підгрупі V-ої групи. Його електронна формула 23V 1s22s22p63s23p63d34s2. Це d-елемент.
Число протонів 23, число нейронів N = A-Z = 51-23 = 28, де: А - округлена атомна маса, Z - порядковий номер елемента.
Тема 3. Хімічна кінетика і рівновага
Завдання 1. Як зміниться швидкість прямої реакції N2 + 3H2 L 2NH3, якщо при незмінній температурі зменшити тиск у 2 рази?
Розв’язок
За законом діючих мас швидкість прямої реакції до зміни тиску можна записати:
![]()
Після зменшення тиску у два рази концентрації реагуючих речовин зменшаться також у два рази, тому швидкість прямої реакції:
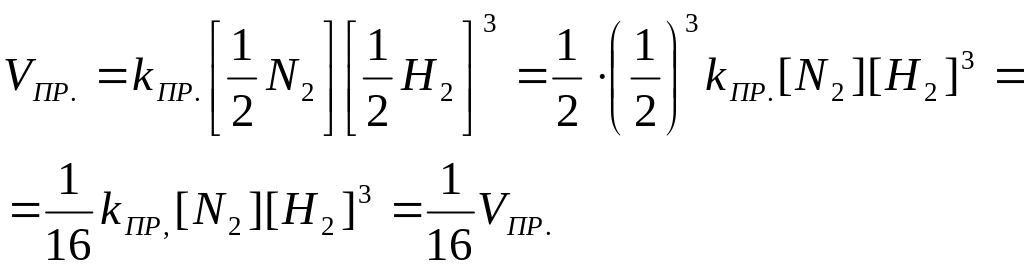
Отже, швидкість прямої реакції зменшиться у 16 разів.
Завдання 2. Як необхідно змінити температуру і тиск в рівноважній системі 4НСІ(г) + О2(г) L 2H2O(г) + 2СІ2(г); ∆Н < 0; щоб змістити рівновагу вліво?
![]()
Розв’язок
За принципом Ле Шательє, щоб змістити рівновагу вліво в даній системі, необхідно підвищити температуру (зворотна реакція є ендотермічною) та понизити тиск (зворотна реакція відбувається зі збільшенням кількості молекул газів, а саме: з 4-х молекул утворюється 5 молекул газів).
Тема 4. Розчини. Способи вираження складу розчинів
Завдання 1. В 1 кг води розчинили 200 г натрій гідроксиду.
Обчислити моляльну концентрацію цього розчину, мольну і масову частку розчиненої речовини.
Розв’язок
Моляльна концентрація - це відношення кількості речовини до маси розчинника в кг.
![]() ,
де:
,
де:
![]() ,
тому
,
тому
![]() .
.
M(NaOH) = 23 + 16 + 1 = 40 (г/моль).
![]()
Мольна частка розчиненої речовини дорівнює відношенню кількості розчиненої речовини до суми кількості речовини всіх компонентів розчину.
![]() ,
де:
,
де:
![]() ,
,
![]() .
.
M(NaOH) = 23 + 16 + 1 = 40 (г/моль)
М(Н2О) = 2 . 1+16 = 18 (г/моль)
Звідси
![]()
![]()
![]()
Масова частка розчиненої речовини – це відношення маси розчиненої речовини до маси розчину, виражене у відсотках.
![]()
mр-ну = mp.p. + mр-ка; mр-ка = р . V.
mр-ка
=
1
![]() .
1000
.
1000
![]() =
1000
=
1000![]()
mр-ну = 40 +1000 = 1400
![]() %
= 2,86%
%
= 2,86%
Завдання 2. Обчислити масу натрій карбонату Na2CO3, що міститься в 500 мл розчину, молярна концентрація еквівалента якого 0,3 моль/л.
Розв’язок
Молярна концентрація еквівалента – це відношення кількості речовини еквівалента до об’єму розчину.
![]() де:
де:
![]() ;
;
![]()
Еквівалентне число z для солі дорівнює добутку валентності елемента на число його атомів в солі.
Отже,
![]()
Звідси МЕ (Na2CO3) = ½ . (23.2+12+16.3)=53 (г/моль).
З формули![]() визначимо масу розчиненої речовини:
визначимо масу розчиненої речовини:
m = CЕ .МЕ .V; m = 0,3 моль/л · 53 г/моль · 0,5 л = 7,95 г.
