
- •Полтавський університет економіки і торгівлі Кафедра хімії
- •6.030510. „Товарознавство і торговельне підприємство”,
- •Модуль 1. Основи загальної хімії.
- •Тема 1. Основні поняття хімії.
- •Тема 7. Хімія неметалів
- •Тема 8. Хімія металів
- •Тема 9. Загальні властивості перехідних металів
- •Тематичний план дисципліни Хімія (і семестр)
- •Методичні рекомендації до вивчення дисципліни “Загальна та неорганічна хімія” основи загальної хімії
- •Тема 1. Основні поняття хімії.
- •Методичні поради до вивчення теми
- •Термінологічний словник
- •Тема 2. Будова атома. Періодична система Методичні поради до вивчення теми
- •Періодичний закон(д.І. Менделєєв, 1869 р.):
- •Термінологічний словник
- •Лабораторне заняття № 1 (4 години)
- •Тема 2. Будова атома. Періодична система План лабораторного заняття №1
- •Тема 3. Класи неорганічних сполук. Методичні поради до вивчення теми
- •Гідроксиди
- •Термінологічний словник
- •Лабораторне заняття № 2
- •Тема 3. Класи неорганічних сполук
- •Дослід 1. Зміна забарвлення індикаторів в різних середовищах
- •Дослід 2. Одержання малорозчинних основ
- •Дослід 3. Амфотерні гідроксиди
- •Тема 4. Окисно-відновні реакції. Методичні поради до вивчення теми
- •Величину та знак ступеня окиснення визначають, виходячи з положень:
- •Термінологічний словник
- •Лабораторне заняття № 3 Тема. Окисно-відновні реакції (6 годин) План лабораторного заняття № 3
- •Дослід 1. Взаємодія Калію йодиду з хлорною водою.
- •Дослід 2. Витіснення Водню із кислоти металами.
- •Дослід 3. Залежність характеру відновлення перманганату Калію від середовища.
- •Тема 5. Вода. Розчини. Склад розчинів.
- •Лабораторне заняття № 4(4 години)
- •Тема 5. Вода. Розчини. Склад розчинів. План лабораторного заняття № 4
- •Дослід 1. Визначення густини рідини
- •Дослід 2. Приготування розчину даної концентрації в процентах
- •Дослід 3. Приготування розчину молярної концентрації
- •Дослід 4. Приготування розчину нормальної концентрації
- •Дослід 5. Визначення концентрації кислоти титруванням
- •Обчислення
- •Тема 6. Електролітична дисоціація Методичні поради до вивчення теми
- •Термінологічний словник
- •Тема: Електролітична дисоціація План лабораторного заняття №5 (6 годин)
- •Тема 7 Хімія неметалів Методичні поради до вивчення теми
- •Термінологічний словник
- •Тема: Властивості неметалів та їх сполук
- •Дослід 2. Окислювальні властивості сульфітної кислоти і сульфітів.
- •Дослід 3. Взаємодія концентрованої сульфатної кислоти з металами /дослід виконувати у витяжній шафі/
- •Тема 8. Хімія металів Методичні поради до вивчення теми
- •Термінологічний словник
- •Дослід 1. Взаємодія солей з металами.
- •Дослід 2. Прискорення хімічних реакцій при з’єднанні двох різних металів.
- •Тема 9. Загальні властивості перехідних металів Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторне заняття № 8 (6 годин) Тема: Властивості неперехідних металів. Лужні і лужно-земельні метали і їх сполуки. План лабораторного заняття
- •Дослід 1. Взаємодія лужних і лужно-земельних металів з водою.
- •Дослід 2. Розклад нітрату натрію /одержання малюнку на папері/.
- •Індивідуальні завдання для самостійної роботи студентів та методичні рекомендації до їх виконання Методичні поради до виконання індивідуальних завдань
- •Індивідуальні завдання з дисципліни “Хімія”
- •Порядок і критерії оцінювання знань студентів
- •Перелік питань та типових завдань, що виносяться на модульний контроль
- •Завдання до модуля 1
- •Комплексні контрольні роботи Завдання № 1
- •Завдання № 2
- •Завдання № 3
- •Завдання № 4
- •Завдання № 5
- •Завдання № 6
- •Завдання № 7
- •Завдання № 8
- •Завдання № 9
- •Завдання № 10
- •Завдання № 11
- •Завдання № 12
- •Завдання № 13
- •Завдання № 14
- •Завдання № 15
- •Завдання № 16
- •Завдання № 17
- •Завдання № 18
- •Завдання № 19
- •Завдання № 20
- •Завдання № 21
- •Завдання № 22
- •Завдання № 23
- •Завдання № 24
- •Завдання № 25
- •Завдання № 26
- •Завдання № 27
- •Завдання № 28
- •Завдання № 29
- •Завдання № 30
- •Приклад побудови завдань для поточного модульного контролю
- •Вищий навчальний заклад укоопспілки
- •Полтавський університет економіки і торгівлі
- •Кафедра хімії
- •Модуль 1
- •Критерії оцінювання знань та система нарахування балів
- •Загальна підсумкова оцінка з дисципліни хімія
- •Перелік основної і додаткової навчально-методичної літератури Основна література.
- •Додаткова література.
- •Зміст навчальної програми (іі семестр) Модуль і. Вуглеводні та їх кисневмісні похідні
- •Тема 1.Особливості, будова і класифікація органічних сполук:
- •Тема 2. Вуглеводні. Алкани
- •Тема 3. Ненасичені сполуки
- •Тема 4. Арени
- •Тема 5. Оксисполуки. Спирти. Феноли
- •Тема 6. Карбонільні сполуки (альдегіди і кетони)
- •Тема 7. Карбонові кислоти. Ліпіди
- •Модуль іі. Вуглеводи та нітрогеновмісні сполуки
- •Тема 8. Вуглеводи. Моносахариди.
- •Тема 9. Дисахариди. Полісахариди.
- •Тема 10. Азотовмісні сполуки. Аміни
- •Тема 11. Гетероциклічні сполуки
- •Тематичний план дисципліни іі семестр
- •Методичні рекомендації до вивчення дисципліни “ хімія” модуль 1. Вуглеводні та їх кисневмісні похідні
- •Тема 1. Особливості, будова і класифікація органічних сполук
- •Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторне заняття № 1
- •Тема 1. Особливості, будова і класифікація органічних сполук План лабораторного заняття
- •Дослід 1. Відношення органічних речовин до нагрівання
- •Дослід 2. Відкриття вуглецю і водню у досліджуваній речовині
- •Дослід 3. Відкриття азоту і сірки
- •Дослід 4. Відкриття галогенів
- •Дослід 5. Перекристалізація
- •Перекристалізація з води
- •Дослід 6. Сублімація (возгонка)
- •Дослід 7. Екстракція (витяг)
- •Тема 2. Вуглеводні. Насичені вуглеводні Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторно-практичне заняття № 2
- •Тема 2. Вуглеводні. Алкани План лабораторного заняття
- •Вуглеводні Дослід 1. Одержання метану і дослідження його властивостей
- •Тема 3 ненасичені сполуки Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторно-практичне заняття № 3 План лабораторного заняття
- •Дослід 1. Одержання етилену і вивчення його властивостей
- •Дослід 2. Бромування ненасичених вуглеводнів
- •Дослід 3 . Одержання ацетилену та вивчення його властивостей
- •Література: 1 (58-76), 2 (65-85); 5 (29-38).
- •Тема 4 арени Методичні поради до вивчення теми
- •Тема 5. Оксисполуки. Спирти. Феноли
- •Термінологічний словник
- •Лабораторне заняття № 5 Тема. Оксисполуки. Спирти План лабораторного заняття
- •Дослід 1. Виявлення домішок метилового спирту у етиловому спирті
- •Дослід 2. Утворення алкоголяту та його гідроліз
- •Дослід 3. Окиснення спиртів
- •Дослід 4. Якісна реакція на багатоатомні спирти
- •Дослід 5. Дегідратація гліцерину
- •Тема 6. Карбонільні сполуки (альдегіди і кетони) Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторне заняття № 6
- •План лабораторного заняття
- •Дослід 2. Окиснення альдегідів аміачним розчином аргентум оксид
- •Дослід 3. Окиснення альдегідів купрум (іі) гідроксид
- •Тема 7. Карбонові кислоти Методичні поради до вивчення теми
- •Термінологічний словник
- •Тема 7. Карбонові кислоти План лабораторного заняття
- •Дослід 1. Визначення реакцій середовища деяких кислот
- •Дослід 2. Доведення кислотних властивостей карбонових кислот
- •Дослід 3. Одержання естерів
- •Модуль 2. Вуглеводи та нітрогеновмісні сполуки
- •Тема 8. Вуглеводи. Моносахариди Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторно-практичне заняття № 8 План лабораторного заняття
- •Дослід 1. Доведення наявності гідроксильних груп у моносахаридах
- •Дослід 2. Окиснення моносахаридів гідроксилом міді у лужному середовищі
- •Дослід 3. Окиснення моносахаридів реактивом фелінга
- •Дослід 4. Окиснення моносахаридів аміачним розчином оксиду срібла (реакція срібного дзеркала)
- •Дослід 5. Реакція селіванова на фруктозу
- •Дослід 6. Осмолення моносахаридів
- •Тема 9. Дисахариди. Полісахариди Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторно-практичне заняття № 9
- •Тема 9 . Дисахариди. Полісахариди План лабораторного заняття
- •Дослід 1. Доведення наявності гідроксильних груп у дисахаридах
- •Дослід 2. Розпізнавання дисахаридів, що відновлюють ( редукують) і не відновлюють (нередукують)
- •Дослід 3. Відношення дисахаридів до аміачного розчину оксиду срібла
- •Дослід 4. Відношення дисахаридів до гідроксиду міді при нагріванні
- •Дослід 5. Гідроліз сахарози
- •Дослід 6. Кольорові реакції на сахарозу
- •Тема 10. Азотовмісні сполуки. Методичні поради до вивчення теми
- •Ліцин хлористоводнева сіль гліцину
- •Натрієва сіль гліцину
- •Термінологічний словник
- •Лабораторно-практичне заняття № 10 Тема. Азотовмісні сполуки. План лабораторного заняття №10
- •Дослід 1. Доведення основних властивостей аніліну
- •Дослід 2. Кольорові реакції аніліну
- •Дослід 3. Утворення комплексної мідної солі амінооцтової кислоти
- •Дослід 8. Осадження білка органічним розчинником
- •Дослід 9. Кольорові реакції білка
- •Тема 11. Гетероциклічні сполуки Методичні поради до вивчення теми
- •Термінологічний словник
- •Лабораторно-практичне заняття № 11
- •План лабораторного заняття
- •Дослід 1. Дослідження деяких властивостей фурфуролу
- •Дослід 6. Реакція нікотину з деякими груповими алкалоїдними реактивами
- •Індивідуальні завдання для самостійної роботи студентів та методичні рекомендації до їх виконання Методичні поради до виконання індивідуальних завдань
- •Індивідуальні завдання з дисципліни “Хімія ”
- •Порядок і критерії оцінювання знань студентів
- •Поточне оцінювання знань студентів
- •Перелік питань та типових завдань, що виносяться на модульний контроль
- •Завдання до модуля 1 вуглеводні та їх кисневмісні похідні
- •Алкени. Дієнові сполуки.
- •Ароматичні сполуки
- •Альдегіди. Кетони.
- •Карбонові кислоти
- •Ліпіди. Жири
- •Завдання до модуля 2 Вуглеводи та нітрогеновмісні сполуки оКсикислоти. ВУглеводи
- •Олігосахариди. Дисахариди. Вищі полісахариди
- •Азотовмісні сполуки
- •Приклад побудови завдань для поточного модульного контролю
- •Вищий навчальний заклад укоопспілки
- •Полтавський університет економіки і торгівлі
- •Кафедра хімії
- •Модуль 1
- •Приклад побудови завдань для поточного модульного контролю
- •Вищий навчальний заклад укоопспілки
- •Полтавський університет економіки і торгівлі
- •Кафедра хімії
- •Модуль 2
- •Перелік питань для підготовки до підсумкового контролю
- •Критерії оцінювання знань та система нарахування балів
- •Розподіл балів за результатами вивчення дисципліни
- •Перелік основної і додаткової навчально-методичної літератури Основна література.
- •Додаткова література.
Дослід 3. Окиснення спиртів
МАТЕРІАЛИ: етиловий, метиловий спирти, хромова суміш, розчин сірчаної кислоти, мідна спіраль.
1. Окиснення спиртів хромовою сумішшю.
Внести у пробірку 2 краплі етилового спирту, додати краплю 2н H2SO4 і 2 краплі 0,5н K2Cr2O7. Отриманий розчин обережно нагріти. Спостерігати зміну кольору і появу характерного запаху “прілих яблук” - оцтового альдегіду. Одну краплю отриманого розчину перенести в пробірку з 3 краплями розчину фуксинсірчистої кислоти. Поява фіолетового кольору свідчить про присутність альдегіду. Реакція може бути використана для відкриття етилового спирту. Привести механізм реакції.
2. Окиснення і дегідрування метилового спирту.
Одну краплю метилового спирту помістити у пробірку. Розжарити мідну спіраль, поки не почервоніє, і внести в пробірку зі спиртом. Звернути увагу на зміни, що відбуваються зі спіраллю і на появу характерного запаху. Вийняти спіраль; у розчин додати дві краплі фуксинсірчистої кислоти. З'являється характерний колір, що свідчить про присутність альдегіду. Представити хімізм окиснення і дегідрування спирту.
Дослід 4. Якісна реакція на багатоатомні спирти
МАТЕРІАЛИ: 0,2н розчин CuSO4, концентрований розчин NaOH, гліцерин.
Помістити у пробірку 3 краплі розчину CuSO4 і 3 краплі концентрованого розчину лугу. До отриманого студенистого осаду долити по стінках пробірки гліцерин. Струснути. На основі явищ, що спостерігаєте, напишіть рівняння реакцій, які при цьому відбуваються. Які властивості гліцерину виявляються в реакції з гідроксидом міді?
Дослід 5. Дегідратація гліцерину
МАТЕРІАЛИ: гідросульфат калію - кристали, гліцерин.
У суху пробірку насипати шар у 1см KHSO4 і змочити його 2 краплями гліцерину. Суміш дуже нагріти (під тягою). Спостереження. Представити утворення акролеїну з гліцерину.
Література: 1 (113-139), 2 (159-184); 5 (74-86).
Тема 6. Карбонільні сполуки (альдегіди і кетони) Методичні поради до вивчення теми
Альдегіди і кетони мають функціональну групу ¾С¾ - карбонільну групу. ||
О
В альдегідах карбонільна група зв’язана з вуглеводневим радикалом і воднем:
R - C - H
||
O
У кетонів карбонільна група зв’язана з двома вуглеводневими радикалами:
R - C - R
||
O
Альдегіди і кетони схожі у властивостях, так як мають однакову функціональну групу.
За номенклатурою IUPAC альдегіди називають, виходячи з назв відповідних вуглеводнів, додаючи закінчення –аль.
Часто альдегіди називають по кислотам, в які вони окиснюються:
H - C = O CH3 - C = O CH3 - CH2 - CH2 - C = O
 Н
Н Н
Н
Н Н
метаналь етаналь бутаналь
(мурашиний альдегід) (оцтовий альдегід) (масляний альдегід)
Назви кетонів утворюють від назв відповідних вуглеводнів, додаючи закінчення -он. Для позначення місця карбонільної групи в молекулі кетону нумерують атоми вуглецю найдовшого ланцюга, починаючи з того кінця, до якого ближче міститься карбонільна група, наприклад:
![]()

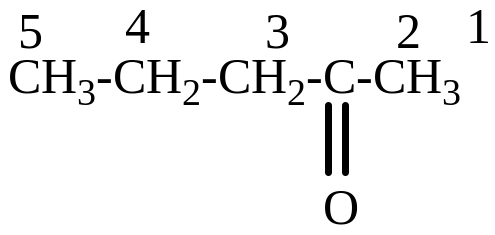
пропанон бутанон-2 пентанон-2
Альдегіди і кетони сполуки дуже активні. Основним типом хімічної реакції для альдегідів і кетонів є реакція приєднання водню і сполук, які мають легко рухомий водень (H2, H - CN, NaHSO3). Слід звернути увагу на те, що альдегіди легко окиснюються в кетони на відміну від кетонів, які окиснюються важко.
Якісними реакціями окиснення на альдегіди є реагенти: Cu(OH)2, Ag2O, реактив Фелінга.
CH3
- C = O +Ag2O
![]() CH3
- C = O
CH3
- C = O
H OH
оцтова кислота
Крім цього, для альдегідів і кетонів характерна реакція заміщення кисню, реакції в радикалі. Карбонільна група >С=О входить до складу сполук інших класів.
