
- •Методичні вказівки до виконання контрольної роботи
- •І. Основні поняття й закони хімії
- •2. Будова атому
- •3. Періодичний закон д.І. Менделєєва та його сучасне трактування на осонві теорії будови атома. Хімічний зв'язок і будова молекул.
- •4. Основні класи неорганічних сполук.
- •5. Розчини.Способи вираження концентрації розчинів
- •6.Електролітична дисоціація. Обмінні реакції в розчинах електролітів. Гідроліз солей
- •7.Окисно-відновні реакціі
- •8. Комплексні сполуки.
- •Середа і.П. Конкурсні задачі з хімії. — к.: Вища шк., 1995.
Методичні вказівки до виконання контрольної роботи
Виконання контрольної роботи є однією із складових самостійної роботи студента під час вивчення курсу неорганічної хімії. Безпосередньому виконанню роботи передує вивчення теоретичного матеріалу одночасно з детальним розглядом прикладів розв’язання типових для кожного розділу завдань. Такі приклади наведені на початку відповідного розділу цих вказівок. На цьому етапі і під час виконання завдання можна використовувати навчальні посібники з наведеного в кінці вказівок списку літератури. Не слід переходити до вивчення нових розділів курсу, доки детально не вивчений попередній.
Кожен студент виконує індивідуальний варіант контрольної роботи. Розв'язання завдань і відповіді на теоретичні запитання повинні бути короткі, але чітко обґрунтовані, за винятком тих випадків, коли по суті питання таке мотивування не потрібне, наприклад, коли треба скласти електронну формулу атома, написати рівняння реакції тощо. При розв'язанні завдань слід наводити весь хід розв'язання й математичні перетворення.
Контрольна робота повинна бути акуратно оформлена в окремому зошиті, для зауважень і позначень рецензента слід залишати широкі поля. Номери й умови завдань необхідно переписувати в тій послідовності, в якій вони вказані у варіанті контрольної роботи. Робота повинна бути датована, підписана студентом і своєчасно подана на рецензування.
Незараховану роботові, у якій є істотні помилки, слід виконати повторно відповідно до вказівок рецензента й подати на рецензування разом з незарахованою роботою. Виправлення потрібно виконати в кінці зошита, а не в рецензованому тексті.
Контрольна робота, яка виконана не за своїм варіантом, викладачем не рецензується й не зараховується.
З а г а л ь н а х і м і я
І. Основні поняття й закони хімії
Визначити еквіваленти та молярні маси еквівалентів для речовин: 1) Cu(OH)2; 2) H3PO4; 3) Cr2(SO4)3; 4)W2O5
Визначити еквіваленти та молярні маси еквівалентів для речовин: 1) Сl2O7; 2)Al2(SO4)3; 3) Н3РО4; 4) КОН;
Визначте еквівалент та еквівалентну масу речовин: Sb2O5; Sn(SO4)2; H2SeO4; Mn(OH)4
Обчислити молярні маси еквівалентів речовин H2CO3 і Fe(OH)3 у реакціях:
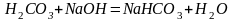 (1)
(1)
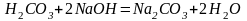 (2)
(2)
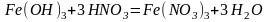 (3)
(3)
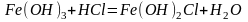 (4)
(4)
Визначити молярні маси еквівалентів для окисників і відновників прямої та зворотної реакції:

K2Cr2O7 + HCl
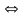 CrCl3
+ Cl2 + KCl + H2O
CrCl3
+ Cl2 + KCl + H2O
Сульфатна кислота масою 4,9 г прореагувала з гідроксидом калію масою 2,8 г. Визначте молярну масу еквівалента сульфатної кислоти і напишіть рівняння реакції.
При відновленні воднем 10,17 г оксиду двовалентного металу утворилося 2,25 г води, молярна маса еквівалента якої 9,00 г/моль. Обчисліть молярні маси еквівалентів оксиду і металу й атомну масу металу. Чому дорівнює об'єм (н.у.) водню, що прореагував у реакції?
При згорянні сульфуру в оксигені утворилося 12,8 г SО2. Скільки еквівалентів оксигену витрачено на цю реакцію? Чому дорівнюють молярні маси еквівалента сульфуру і його оксиду?
З 1,3 гідроксиду металу виходить 2,85 г сульфату цього ж металу. Обчисліть молярну масу еквівалента металу.
В 2,48 г оксиду одновалентного металу міститься 1,84 г металу. Обчисліть молярні маси еквівалентів металу і його оксиду.
Чому дорівнює молярна маса еквіваленту води при взаємодії її з:
а) з натрієм; б) з оксидом натрію.
На нейтралізацію 0,943 г фосфатної кислоти Н3РО3 витрачено 1,291 г KOH. Обчисліть молярну масу еквівалента кислоти і її основність.
